Нет.
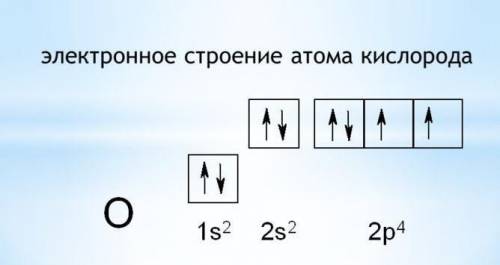
У Кислорода на внешнем уровне(2 уровень), в подуровне р-, два электрона без пары, за счёт них образуются стабильные две связи — валентность II всегда.
У Серы есть ещё и третий уровень, в котором есть s-, p- и d- подуровни. Поэтому у серы больше валентностей. В возбуждённом состоянии сера может проявлять валентность IV и VI кроме II.
Под n на рисунке подразумевается номер уровня.
16S 1s2 2s2 2p6 3s2 3p4 — валентность II, H2S;
16S* 1s2 2s2 2p6 3s2 3p3 3d1 — валентность IV, SO2;
16S** 1s2 2s2 2p6 3s1 3p3 3d2 — валентность VI, Na2SO4
На рисунке представлен внешний электронный уровень у серы в соединениях, указанных в качестве примеров.
У кислорода валентность II ВСЕГДА. Что в простом веществе O2, что в соединении H2O

Я не уверена, что ответ правильный. Но все, что мне пришло в голову, напишу.
Лед -твердое агрегатное состояние вещества. Молекулы вещества близки друг к другу и практически не двигаются.
Лед и вода -фаза перехода из твердого в жидкое состояние вещества. Молекулы начинают двигаться активнее, расстояние между ними увеличивается.
Вода -жидкое состояние вещества. Молекулы активно двигаются, между ними есть расстояние.
Лед и вода -фаза перехода из жидкого в твердое. Молекулы...как бы придвигаются ближе друг к другу.
И тд и тп. Я не знаю, то ли это.
Объяснение:
HCl + KOH = KCl + H2O
m(KOH) = m(p-pa)*W(KOH) = 200*0,05 = 10 г
n(KOH) = m(KOH)/M(KOH) = 10/56 = 0,18 моль
По уравнению n(KCl) = n(KOH) = 0,18 моль
m(KCl) = n(KCl)*M(KCl) = 0,18*74,5 = 13,41