Відповідь:
становите соответствие между формулой вещества и его принадлежностью к определенному классу (группе) неорганических соединений.
Химическая формула
: А) СrО; о1) сновной оксид;
Б) Сr2О3 2) амфотерный оксид
; В) Н3ВО3; 3) кислород-содержащая кислота;
Г) К3[Fе(СN)6]. 4) комплексная соль;
2. Амфотерным и основным оксидами соответственно являются:
а) ZnО, Nа2О;
3. Только соли расположены в ряду:
б) СаВr2, Аl(ОН)2Сl, NаI;
4. К основным оксидам относится:
а) ВаО;
5. К кислым солям не относится вещество, формула которого:
1) NH4Cl
6. К слабым кислотам относятся: 1) H2S 2) H2SO3 4) H2SiO3 5) HNO2
7. Установите соответствие между формулами оксидов и названием класса (группы), к которому они принадлежат.
Название оксида: А) оксид углерода (II);3) несолеобразующий оксид;
Б) оксид бария;2) основной оксид;
В) оксид фосфора (V);1) кислотный оксид;
Г) оксид азота (I). 3) несолеобразующий оксид;
8. Установите соответствие между формулой соли и названием класса (группы), к которому она принадлежит.
Формула соли:
А) ВаSО4; 1) средняя;
Б) Са(НСО3)2; 2) кислая;
В) СuОНNО3; 3) основная;
Г) КСl•NаСl. 5) двойная.
9. Установите соответствие между формулами оксидов и характером их свойств.
Формулы оксидов:
А) Р2О3, СrО3, В2О3;3) кислотный оксид;
Б) СО, N2О, NО;4) несолеобразующий оксид.
В) ZnО, Аl2О3, ВеО; 1) амфотерный оксид;
Г) СаО, Nа2О, МnО. 2) основной оксид
10. Установите соответствие между названием вещества и классом (группой) неорганических соединений, к которому оно относится.
Название вещества:
А) азотистая кислота; 6) кислота кислородсодержащая.
Б) нитрат меди (II); ) средняя соль
В) гидроксид меди (II); 4) основание
Г) гидроксохлорид меди (II). 5) основная соль
11. Амфотерным и основным оксидами соответственно являются:
б) Аl2О3, SrО;
12. Кислотным и основным оксидом соответственно являются:
1) SO3 и MgO
13. Установите соответствие между формулой кислоты и соответствующего этой кислоте оксида.
Формулы кислот:
А) НРО3; 1) Р2О3;
Б) Н3РО4; 2) Р4О10;
В) Н4Р2О7; Р2О7.
Г) Н2СrО4. 3) СrО3
14. Установите соответствие между формулой соли и названием класса (группы), к которому она принадлежит.
Формула соли:
А) Fе2(SО4)3; 1) средняя
Б) [Аg(NН3)2]Сl; 4) комплексная
В) КАl(SО4)2;5) двойная.
Г) (FеОН)2SО4. 3) основная
15. Установите соответствие между формулами оксидов и характером их свойств.
Формулы оксидов:
А) СО, NО, N2О;4) несолеобразующий оксид.
Б) К2О, ВаО, СuО; 2) основной оксид
В) СО2, SО3, Мn2О7;3) кислотный оксид;
Г) ZnО, Fе2О3, МnО2. 1) амфотерный оксид
16. Установите соответствие между названием вещества и классом (группой) неорганических соединений, к которому оно относится.
Название вещества:
А) гидроксохлорид алюминия;5) основная соль
Б) сероводородная кислота; 1) бескислородная кислота;
В) сернистая кислота; 3) кислородсодержащая кислота;
Г) гидрокарбонат натрия. 4) кислая соль
К
17. Установите соответствие между формулой вещества и его принадлежностью к определенному классу (группе) неорганических соединений.
Химическая формула:
А) Nа2SО4; средняя соль
Б) СrО2(ОН)2;
В) N2О; 1) несолеобразующий оксид;
Г) К[Аl(ОН)4]. комплексная соль
18. Амфотерным и основным оксидами соответственно являются:
а) ZnО, Nа2О;
19. Какому из указанных оксидов не соответствует гидроксид?
1; 3) оксиду углерода (II);
20. Амфотерным и основным оксидами являются соответственно:
2) Аl2О3 и К2О;
Пояснення:
1) Электролиз:
2NaBr = 2Na + Br2.
2) Это гальванический элемент Даниэля:
Две разделенные перегородкой емкости. В одной цинковый электрод, погруженный в раствор сульфата цинка, в другой - медный электрод, погруженный в раствор сульфата меди. При замыкании цепи образуется эл. ток вызванный эдс, равной примерно разности стандартных электродных потенциалов меди и цинка. (При условии примерно равной концентрации растворов сульфатов меди и цинка).
Е = Е(Cu) - E(Zn) = 0,337 - (-0,763) = 1,1 В.
Формула окислительно-восстановительной реакции:
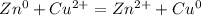
3) Уравнения гидролиза CH3COOK:
В молекулярной форме:
CH3COOK + H2O = CH3COOH + KOH.
В полной йонной форме:
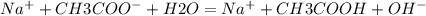
В сокращенной ионной форме:

Слабая кислота и сильное основание дают щелочную реакцию с pH>7.
4) По определению молярности раствора:
0,2 = m/(M*V), где m - искомая масса соли, M = M(NaNO3) = 85 г/моль,
V = 400 мл = 0,4 л.
m = 0,2*0,4*85 = 6,8 г
ответ: 6,8 г.
5) 4H2O2 + 4KMnO4 = 4MnO2 + 4KOH + 5O2 + 2H20
Перманганат(MnO4^(-1)) выступает в роли окислителя, а конкретно - марганец. Он принимает 3 электрона и степень окисления становится (+4)
Mn(+7) + 3e = Mn(+4)
Еще в роли окислителя выступают два иона ОН в перекиси водорода:
2ОН(0) + 2е = 2ОН(-1)
Кислород восстановитель
2О(-2) - 4е = О2(0)
Теперь выставляем коэффициенты по диагонали, делая электронный баланс. Перед свободным кислородом ставим коэффициент (3+2) = 5, а перед перекисью и марганцовкой ставим по 4. Остальные коэффициенты получаются автоматически.