Швидкість реакції характеризує зміну кількості речовини її компонентів (реагентів чи продуктів) за певний проміжок часу.
Нам відомо, що реакції проходили однакову кількість часу, тож швидкість реакції буде більша в тому реакторі, в якому за цей проміжок утворилася більша кількість речовини вуглекислого газу.
1 реактор:
Формула кількості речовини:
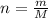
Знайдемо молярну масу вуглекислого газу:
M (CO₂) = 12 + 2 * 16 = 44 (г/моль).
Тепер знайдемо кількість речовини:
n (CO₂) = 6,6 : 44 = 0,15 (моль).
2 реактор:
Формула кількості речовини:
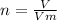
Vm (молярний об'єм) газів за нормальних умов дорівнює 22,4 л\моль.
Знайдемо кількість речовини:
n (CO₂) = 4,48 : 22,4 = 0,2 (моль).
Порівняємо кількості речовин вуглекислого газу, що виділився в першому і другому реакторах:
n₁ < n₂
Значить, в другому реакторі швидкість реакції більша.
Відповідь: у другому.
Дано: m(S)=0.8г
m(р-ра)=100г
ω(NaOH)=4%
Найти:
ω(NaHSO3)=?
S+O2=SO2
n(S)=m(S)/M(S)=0.8/32=0.025 моль
n(SO2)=n(S)=0.025 моль
m(NaOH)=ω(NaOH)⋅m(р-ра)/100=4⋅100/100=4г
n(NaOH)=m(NaOH)/M(NaOH)=4/40=0.01 моль
SO2 в избытке, поэтому реакция будет идти по следующей схеме:
SO2+NaOH=NaHSO3
n.(SO2)=n(NaOH)=0.01 моль
m.(SO2)=nг.(SO2)⋅M(SO2)=0.01⋅64=0.64г
m2(р-ра)=m(р-ра)+m(SO2)=100+1.6=101.6г
n(NaHSO3)=n(NaOH)=0.01 моль
m(NaHSO3)=n(NaHSO3)⋅M(NaHSO3)=0.01⋅104=1.04г
ω(NaHSO3)=100⋅m(NaHSO3)/m2(р-ра)=100⋅1.04/101.6=1.02%
ответ: ω(NaHSO3)=1.02%
Надеюсь что
Al --- P --- S --- Cl --- O