1) Возьмем 1 моль данного соединения и рассчитаем сколько в 1 моле содержится граммов кальция:
310 г 100%
Х г 38,75%
Х = 310*38,75/100 = 120 г
А так как 1 моль атомов кальция имеет массу 40 г, то в 1 моле вещества содержится 3 моля атомов кальция.
2) Аналогично проводим определение для атомов фосфора и кислорода и получаем, что 1 молекуле вещества содержится 3 атома кальция, 2 атома фосфора и 8 атомов кислорода.
Эмпирическая формула соединения: Са₃Р₂О₈
Молекулярная формула: Са₃(РО₄)₂ - фосфат кальция.
ответ: 2,24 л
Объяснение:
NaHCO3 + HCl = NaCl + H2O + CO2↑
m(HCl) = 7,3г
M(HCl) = 36,5 г/моль
m(NaHCO3) = 8,4г
M(NaHCO3) = 84 г/моль
Vм = 22,4 л/моль- постоянное число, молярный объём
n(HCl) = m/M = 0,2 моль
n(NaHCO3) = m/M = 0,1 моль
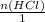 = 0,2 >
= 0,2 > 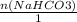 = 0,1 моль
= 0,1 моль
значит, считаем по NaHCO3
n(CO2) = n(NaHCO3) = 0,1 моль
V(CO2) = n*Vм = 0,1 * 22,4 = 2,24 л
Если даны массы нескольких исходных веществ, то расчет по уравнению реакции проводят по тому из веществ, которое находится в недостатке, т.е. первым заканчивается в реакции.
Для того, чтобы узнать, какое из веществ находится в недостатке, сравнивают их относительные количества, т.е. количества, деленные на соответствующие коэффициенты в уравнении реакции.
хром III проявляет амфотерные св-ва
3. Только основные свойства проявляет оксид (амфотерные не проявляет):
в) MnO
4. Амфотерные свойства проявляет гидроксид:
г) хрома (III)
5. Основные свойства гидроксидов увеличиваются в ряду:
б) Mg(OH)2 — Ca(OH)2 — KOH
6. Вода реагирует с каждым из оксидов, содержащихся в паре:
г) K2O & BaO т.к. они щелочные и щелочно-земельные элементы
7. Гидроксид натрия реагирует с каждым из оксидов, содержащихся в паре: г) Cr2O3 & Fe2O3 т.к. обладают амфотерн. св-вами
8. И оксид цинка, и оксид калия реагируют с: г) соляной кислотой
9. И оксид алюминия, и гидроксид цезия реагируют с:
а) азотной к-той
10.И гидроксид натрия, и гидроксид алюминия реагируют с:
г) азотной кислотой