Карбоновые кислоты - органические вещества, которые имеют в своём составе карбоксильную группу (-СООН)(1 или несколько) с общей формулой R-COOH, где R - алкильный заместитель.
Классифицировать можно по количеству основ(т.е. карбоксильных групп): 1-, 2- и многоосновные.
По силе (средней силы и слабые).
По насыщенности (предельные, непредельные).
Так же они могут быть циклическими и нециклическими.
Только муравьиная кислота применяется в качестве окислителя благодаря одной особенности - а именно отсутствию электрондонорных заместителей(исключая тот единственный фрагмент -СН3), которые ослабляют кислотные свойства, в следствии смещения электронной густоты от себя.(такими могут быть -СН3, -С2Н5 и т д.).
Всё остальное на листочке:
*Ме - какой-то металл в соли,
[О] - окислитель.
У метилэтилового эфира изомеры пропанол-1 и пропанол-2. Они не влезли просто.
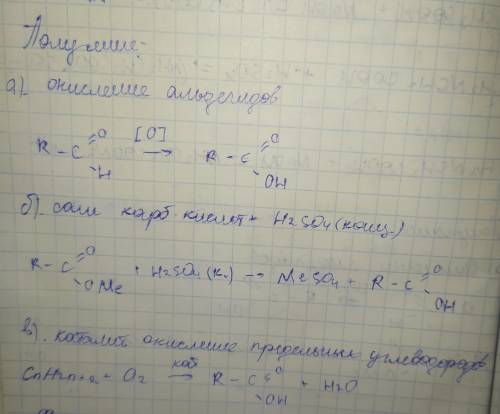




Объяснение:
При повышении температуры на 10°С скорость некоторой химической реакции возрастает в 2 раза. При температуре 20°С она равна 0,05 моль/л•час. Какова будет скорость этой реакции при температуре 0°С ?
Поскольку сказано, что при повышении температуры на 10°С скорость некоторой химической реакции возрастает в 2 раза. То значит 2 это - термический коэффициент скорости реакции. При понижении температуры естественно скорость реакции уменьшится в 2 раза
Нам известна скорость реакции при температуре 20° С.
Температура Скорость протекания реакции
20° С 0,05 моль/л•час
10° С 0,025 моль/л•час
0° С 0,0125 моль/л•час
87,5 л
Объяснение:
какой объем кислорода потребуется для сжигания 25 литров этана?
25 л
C2H6 + 3,5O2 = 2CO2 + 3H2O
По закону объемных отношений (для газов) : объемы газов взаимодействующих между собой до конца относятся друг к другу как простые целые числа равные коэффициентам в уравнении реакции.
В уравнении горения этана на 1 объем этана приходится 3,5 объема кислорода. Составим пропорцию:
1 об 25 л 25 × 3,5
= х = 87,5 л
3,5 об х л 1