Реакции, протекающие в смеси:
CH4 + H2 =\=
CH2=CH2 + H2 = CH3-CH3
Так как гидрирование полное, то в реакцию вступает весь этилен.
Молярная масса смеси газов до реакции:
M1 = 11 * 2 = 22 г/моль.
Молярная масса смеси газов после реакции:
M2 = 11.25 * 2 = 22.5 г/моль.
Исходя из стехиометрии реакции и делая допущение об идеальности газовой смеси, объёмные доли газов до и после реакции соотносятся следующим образом:
F(CH4) = const = F1
F(CH2=CH2) = F(CH3-CH3) = F2
Составим систему линейных алгебраических уравнений(СЛАУ):
M1 = F1*MA + F2*MB
M2 = F1*MA + F2*MC
Решение СЛАУ:
M2 - M1 = F1*MA + F2*MC - F1*MA - F2*MB
M2 - M1 = F2*MC - F2*MB
Объёмная доля этилена, вступившего в реакцию:
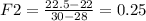 (25%)
(25%)
Лакмусовая бумага фиолетового цвета. В ЩЕЛОЧНОЙ СРЕДЕ ОНА МЕНЯЕТ ЦВЕТ НА СИНИЙ, А В КИСЛОЙ СРЕДЕ ОНА СТАНОВИТСЯ КРАСНОЙ.
1) Цвет лакмусовой бумаги, опущенной в смесь оксида и воды:
c) CaO 1.синий
CaO+H₂O=Ca(OH)₂ (щелочь, гидроксид кальция)
а) CrO₃ 2.красный
CrO₃+H₂O=H₂CrO₄ (хромовая кислота)
e) SO₂ 2.красный
SO₂+H₂O=H₂SO₃ ( сернистая кислота)
2) Цвет лакмусовой бумаги, опущенной в смесь оксида и воды:
b) K₂O 1.синий
K₂O+H₂O=2KOH (щелочь, гидроксид кальция)
d) Mn₂O₇ 2.красный
Mn₂O₇+H₂O=2HMnO₄ ( марганцовая кислота)
e) P₂O₅ 2.красный
P₂O₅+3H₂O=2H₃PO₄ (фосфорная кислота)
1. Ионы – это заряженные частицы, в которые переходят атомы при отдаче или принятии электронов. Катион – положительно заряженный ион. Это ионы.Катион - положительно заряженный(например,К+,Na+),а анион - отрицательно(Cl-,S2-)
2. Так как любой атом стремится к завершению последнего электронного слоя, то атомам металлов 1 и 2 а групп проще отдать 1-2 электрона, чем принимать около 6-7 штук. Например у магния 2 электрона на внешнем слое, поэтому ему проще отдать два электрона другим атомам, чем принять 6 для завершения слоя.
С неметаллами почти наоборот. Неметаллы шестых или седьмых групп стремятся наоборот принять электрон, чтобы завершить последний электронный слой, поэтому им проще взять парочку, чем отдавать кучу. Например у серы на последнем уровне 6 электронов, поэтому для завершения слоя ему проще принять всего 2 электрона.
3. Потому что у неметаллов на внешнем электронном слое всегда есть незавершенные орбитали, требующие для завершения принятия 1 или более недостающих электронов.
4. x- O (кислород)
y-Al +3 (катион алюминия)
z- K+ (катион калия)
Объяснение: