Привет! Сейчас решим
1. Сера в природе встречается в самородном виде, а также входит в состав сульфидов и сульфатов. Например, цинковая обманка – ZnS, FeS2 – пирит, Cu2S – медный колчедан.
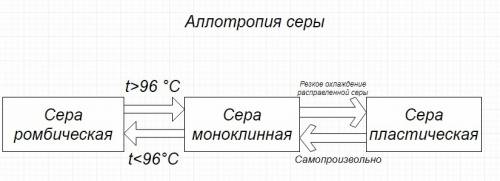
2. Существует несколько аллотропных модификаций серы. Ромбическая представляется собой желтый порошок с tпл = 113 – наиболее устойчивая форма серы. При 96 градусах ромбическая сера превращается в моноклинную. Она уже представляет собой темно-желтые иглы. Если их расплавить и резко охладить, получим серу пластическую – коричневую резиноподобную массу. Она неустойчива и постепенно превратится в ромбическую серу, когда полностью остынет.
3. Сера более электроотрицательный элемент, по сравнению с металлами, поэтому она отнимать электроны у последних, приобретая отрицательную степень окисления. А вот галогены и кислород более электроотрицательны, чем сера. Поэтому, они уже у серы отнимают электроны, и возникает положительная степень окисления.
4. Составим уравнение химической реакции. S + O2 = SO2
Как видно из уравнения, для сжигания 1 моль серы требуется 1 моль кислорода. n(S) = 4:32 = 0,125 моль. n(O2) = 0,125 моль. V(O2) = 22,4*0,125 = 2,8 литра. V(возд) = 2,8:0,2 = 14 литров
5. Поскольку серы увеличивает свою степень окисления от -2 (H2S) до +6 (SO3), окислительные свойства растут, а восстановительные – снижаются. Наиболее сильный окислитель – SO3, восстановитель – H2S.
6. S + O2 = SO2 + 332,8 кДж. Из уравнения реакции видно, что при окислении 1 моль серы выделяется 332,8 кДж тепла. n(S) = 1:32 = 0,03125 моль. Q = 0,03125*332,8 = 10,4 кДж
7. Краткая схема представлена во вложении
Готово!
Відповідь:
V(CO₂)=22.4 л
Пояснення:
Дано: m(суміші)=212 g w(Na₂CO₃)=50%. V(CO₂)-?
I. Запишемо рівняння:
Na₂CO₃ + 2 CH₃COOH → H₂O + CO₂↑ + 2 CH₃COONa
За рівнянням видно, що натрій карбонат і вуглекислий газ у співвідношенні, як 1:1.
Тобто, n(Na₂CO₃ )=n(CO₂)
II. Виконаємо обчислення :
n(E)=m(E)/Mr(E)
w(E)=m(E)/m(розчину) · 100%
m(E)=w(E)*m(розчину) / 100%
n(E)=V(E)/Vm
V(E)=n(E)*Vm
m(Na₂CO₃)=212*50/100=106 g
n(Na₂CO₃)=106/106=1 моль=n(CO₂)
V(CO₂)=n(CO₂)*Vm= 1*22.4 = 22.4 л
*Поставте найкраще, будь ласка :)