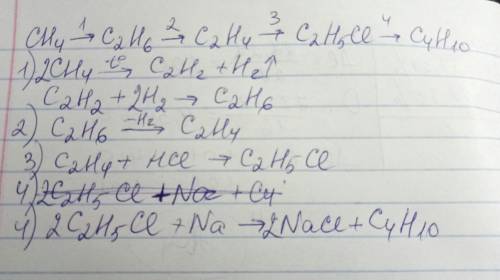
Объяснение:
Практическая работа № 5.
Приготовление раствора сахара и расчет его массовой доли в растворе.
Цель работы: приготовить раствор сахара и расчитать его массовую долю в растворе.
Ход работы:
1. Отмерьте мерным цилиндром 100 мл дистиллированной воды и влейте ее в коническую колбочку емкостью 200мл.
2. 2 чайных ложки сахарного песка (или 4 кусочка) взвесьте на лабораторных весах. Масса сахара 20г.
3. Опустите сахар в колбочку с водой и перемешивайте стеклянной палочкой до полного растворения.
4. Рассчитайте массовую долю сахара в растворе. Необходимые данные у вас есть: масса сахара 20г., объем воды 100мл.( плотность воды 1 г/мл.), значит масса воды будет 100г.
Дано:
m(H₂O) =100г.
m (сахара) =20г.
Найти: ω(сахара)-?
ω%(сахара)-?
1. Определим массу раствора сахара:
m(раствора сахара)= m(сахара) + m(H₂O)
m(раствора сахара)=20г.+100г.=120г.
2. Определим массовую долю сахара:
ω(сахара)=m(сахара)÷m(раствора сахара)
ω(сахара)=20г.÷120г.=0,1666
3. Определим массовую долю сахара в %:
ω%(сахара)=ω(сахара)×100%
ω%(сахара)=0,1666×100%=16,66%
4. ответ: приготовили раствор сахара с массовой долей 0,1666 или 16,66%.
Объяснение:
1.3)
2. 2) O₂+2H₂=2H₂O CH₄+2O₂=CO₂+2H₂O
3. 3) 2H₂+O₂=2H₂O CuO+H₂=Cu+H₂O
4. (А)
1) 2Na+2H₂O=2NaOH+H₂
4) CaO+H₂O=Ca(OH)₂
7) SO₂+H₂O=H₂SO₃
(Б)
2) 3Fe+4H₂O=Fe₃O₄+4H₂ (t = 700-900 °C)
5) C+H₂O=CO+H₂ (t = 800-1000 °C)
8) Zn+H₂O(пар)=ZnO+H₂
(В)
3) SiO₂+H₂O≠
6) CuO+H₂O≠
5.
1) В 4AI+3O₂=2AI₂O₃
2) А 2AI+3H₂O=AI₂O₃+3H₂ (с парами воды)
3) Б CaO+H₂O=Ca(OH)₂
6.
3) SO₂+H₂O=H₂SO₃
4) CO₂+H₂O⇄H₂CO₃
1) Mg+2H₂O=Mg(OH)₂+H₂ если вода в виде пара
7. 2) O₂+2H₂=2H₂O 2CO+O₂=2CO₂
8. 3) 2H₂+O₂=2H₂O H₂+2K=2KH
9.
(А)
1) Ca+2H₂O=Ca(OH)₂+H₂
2) 2AI+6H₂O=2AI(OH)₃+3H₂ ( алюминий очищен от оксидной пленки)
4) K₂O+H₂O=2KOH
7) SO₂+H₂O=H₂SO₃
(Б)
5) C+H₂O=CO+H₂ (t = 800-1000 °C)
8) 3Fe+4H₂O=Fe₃O₄+4H₂ (t = 700-900 °C)
(В)
3) SiO₂+H₂O≠
6) ZnO +H₂O≠
10.
1) В
2) А SO₂+H₂O=H₂SO₃
3) Б
11. 1) Na₂O+H₂O=2NaOH
3) SO₂+H₂O=H₂SO₃
4) CO₂+H₂O⇄H₂CO₃
12. 1) C₂H₄+3O₂=2CO₂+2H₂O 2CO+O₂=2CO₂
13. 2) Ca+H₂=CaH₂ CuO+H₂=Cu+H₂O
14. 3)