m(KOH)раствора=10*1,4=14г;m(KOH)в растворе=10*0,4=4г;n(KOH)=4:56=0,07моль;n(к-ты)=0,0714286моль
M(к-ты)=7,4г:0,0714286моль=104/моль;
CnH2nO2-общая формула кислот
12n+2n+32=104
14n=72
n=5 ответ: C5H10O2
ответ:
никель – ферромагнитный металл, но его ферромагнетизм выражен значительно меньше, чем у железа и . точка кюри для никеля составляет 358 ˚с, выше этой температуры никель переходит в парамагнитное состояние.
чистый никель – металл серебристого цвета. при высокотемпературном окислении никеля образуются два оксидных слоя: внутренний – светло-зеленый и внешний – темно-зеленый. два этих слоя состоят из оксида, но отличаются количеством кислорода.
никель характеризуется более высокой коррозионной стойкостью в атмосферных условиях по сравнению с другими техническими металлами, что обусловлено образованием на его поверхности тонкой и прочной защитной пленки. никель обладает достаточной устойчивостью не только в пресной, но и в морской воде. минеральные кислоты, особенно азотная, сильно действуют на никель. щелочные и нейтральные растворы солей на никель влияют незначительно даже при нагревании, в кислых растворах солей он корродирует довольно сильно. в концентрированных растворах щелочей никель устойчив даже при высоких температурах.
никель при комнатной температуре не взаимодействует с газами, но присутствие влаги заметно повышает скорость его коррозии в этих средах. никель, загрязненный кислородом, склонен к водородной болезни.
объяснение:
m(кислоты) = 56*7,4/(10*1,4*0,4)=74 г (дробью)
формула пред. одноосновн.: C(x)H(2x)O2 - x и 2х (оформление как в химической формуле).
12*х+2*х+32=74
12х+2х+32=74
14х=74-32
14х=42
х=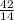
х=3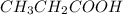
формула: