Объяснение:
Определите, как влияет повышение температуры на смещение равновесия и при какой температуре направление реакции сменится на противоположное (зависимостью ΔH° и ΔS° реакций от температуры пренебречь):
CH4(г.) ⇄ C(графит) + 2H2(г.)
ΔН°₂₉₈ = 74,6 кДж /моль
ΔS°₂₉₈ = + 84,1 Дж/моль·К
Связь энтальпийного (ΔН) и энтропийного – (ΔS) факторов выражает
энергия Гиббса ΔG.
Эта величина названа так в честь американского ученого одного из
основоположников химической термодинамики Д. Гиббса
Δ G = ΔH – T ΔS
где Δ G – изменение энергии Гиббса, ΔH – изменение энтальпии процесса ,
Т – температура по шкале Кельвина, ΔS – изменение энтропии процесса
Связь энтальпийного (ΔН) и энтропийного – (ΔS) факторов выражает
энергия Гиббса ΔG.
Эта величина названа так в честь американского ученого одного из
основоположников химической термодинамики Д. Гиббса
Δ G = ΔH – T ΔS
где Δ G – изменение энергии Гиббса, ΔH – изменение энтальпии процесса ,
Т – температура по шкале Кельвина, ΔS – изменение энтропии процесса
ΔG = ΔH - TΔS
Когда ΔH = TΔS то ΔG = 0 система находится в равновесии при Т = 887 К.
А при Т выше 887 К изменение энергии Гиббса меняет знак на противоположный и реакция будет протекать в обратном направлении
6 г х моль
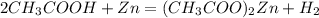
120 г 1 моль
1. Знайдемо чисту массу етанової кислоти у розчині:
m(CH3COOH)=m(розчину)*w(CH3COOH)=50*0,12=6 г
2. Підставивши цю масу у рівняння,розрахуємо кількість речовини водню:
при взаємодії 120 г кислоти виділяється 1 моль водню, а
при -- // -- 6 г____________________х г, звідки
х=6*1/120=0,05 моль
3. А тепер з формули по визначенню кількості речовини, знайдемо:
а) m(H2)=M(H2)*v(H2)=2*0,05=0,1 г
б) V(H2)=Vm(H2)*v(H2)=22,4*0,05=1,12 л