1. А) N2 + 3Н2 = 2NН3 - соединения
Б) 3Mg + 2H3РО4 = Mg3(РО4)2 +3 H2↑ - замещения
В) 2Al(OH)3 = Al2O3 + 3H2O - разложения
Г) 2Cu2O = 4Cu + O2↑ - разложения
2. Na2CO3 + 2HCl = 2NaCl + H2O + CO2 - ионного обмена.
признаки: выделение воды и газа, индикатор показывает нейтральный pH (в первом растворе (Na2CO3) изначально показывалась щелочная среда, во втором (HCl) - кислая)
2 + + 2+2=2+2+ H2O + CO2
+ 2=H2O + CO2
3. 2Mg+O2=2MgO
Магний+кислород=оксид магния
MgO+2HCl=MgCl2+H2O
оксид магния+соляная кислота=хлорид магния +вода
MgCl2+2KOH=Mg(OH)2+2KCl
хлорид магния+гидроксид калия= гидроксид магния + хлорид калия
4. 2 + 6 =2 +3
--3e-> 3 2 окислитель
2-+2e-> 2 3 восстановитель
Объяснение:
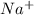

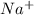
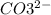

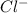
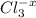


Дано
m(Са)=80 г
m(СаО) -? m(Са(ОН)2-?
m(СаСІ2) -?
М(Са)=40 г/мль
М(СаО)=56 г/моль
М(Са(ОН)2)= 74 г/мольМ(СаСІ2)=111 г/моль
Найдем количество моль кальция n(Са)= m/М=80/40=2 моль
Запишем уравнения
2Са +О2=2СаО
2 2
Соотношение n(Са): n(СаО)=2:2=1:1 значит n(СаО)= 2 моль
m= n*М=2 моль*56 г/моль=112 г СаО
СаО+Н2О= Са(ОН)2
Соотношение n(СаО): n(Са(ОН)2)=1:1 значит n (Са(ОН)2)= 2 моль
m= n*М=2 моль*74 г/моль=148 г Са(ОН)2
Са(ОН)2 +2НСІ= СаСІ2+Н2О
Соотношение n(Са(ОН)2): n(СаСІ2)=1:1 значит n (СаСІ2)= 2 моль
m= n*М=2 моль*111 г/моль=222 г СаСІ2