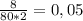 моль
моль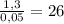 г/моль
г/мольВідповідь:
Дано:
Е2О5
Mr(E2O5)= 142
Знайти:
Е - ?
Розв’язок:
Ar(E)=(Mr(E2O5) – n * Ar(O)) : 2= 62 : 2 = 31
Це Р. Він знаходиться у V групі третього періоду періодичної системи хімічних елементів; неметал; Сусідом Фосфору за підгрупою є Нітроген. Сусідами Фосфору за періодом є Силіцій та Сульфур. Неметалічні властивості атомів хімічних елементів головних підгруп зі зростанням порядкового номера зростають у періодах і знижуються у групах. Тому неметалічні властивості Фосфору більш виражені, ніж у Силіцію та менш виражені, ніж у Нітрогену та Сульфуру.
Будова атома:
1) заряд ядра атома - 15
2) відносна атомна маса хімічного елемента - 31
3) число протонів - 15
4) число електронів - 15
5) число нейтронів 16
6) число електронних рівнів в атомі - 3
m(CxHy)=1.3 г
m(Br2)=8 г
Найти:
M(CxHy)=?
Формула-?
Решение:
Уравнение реакции в общем виде:
Так как углеводород может присоединить бром, то он, скорее всего, относится к классу алкинов.
CnH2n-2+Br2=CnH2n-2Br2
n(Br2)=m/M=8/160=0.05 моль
n(CnH2n-2)=0.05 моль
M(CnH2n-2)=m/n=1.3/0.05=26 г/моль
12n+2n-2=26
14n=28
n=2
Тогда формула: C2H2
ответ: C2H2.