
Задача №1
- Уравнение:
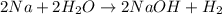
- вычислим количество вещества водорода:
n = V/Vm = 4,48л/22,4л/моль = 0,2 моль
- По уравнению реакции:
n(Na) = 2n(H2) = 0.2моль*2 = 0,4 моль
- Вычисляем массу натрия:
m(Na) = n*M = 0,4моль*23г/моль = 9,2 грамма
Отвеот: масса натрия равна 9,2 грамма
Задача №2
- Уравнение:
CuO + H2 = Cu + H2O
-По уравнению реакции, видим, что:
n(H2) = n(CuO) = 1,5 моль
- Масса 1,5 моль водорода:
m= n*M = 2г/моль*1,5моль = 3 грамма
- По уравнению реакции, видим, что:
n(Cu) = n(CuO) = 1.5 моль
- Рассчитывеам массу 1,5 моль меди:
m = n*M = 1,5 моль*64г/моль = 96 грамм
К первой аналитической группе относятся катионы K+, Na+ и NH4+. Катион NH4+ аммония по ионному радиусу занимает промежуточное положение между K+ и Rb+ и вступает в реакции с реагентами на K+.
Щелочные металлы калий и натрий входят в главную подгруппу первой группы периодической системы Д.И. Менделеева. Атомы их обладают одним s-электроном, расположенным на внешнем энергетическом уровне. Эти элементы образуют катионы Na+ и K+ сферической симметрии, которая обусловливает их устойчивость, отсутствие окраски и слабую поляризуемость.
Катионы Na+ и K+ имеют законченные восьмиэлектронные внешние энергетические уровни: 3s23p6 и 2s22p6 соответственно.
Химические свойства катионов первой аналитической группы определяются главным образом электростатическими взаимодействиями. Большинство солей катионов этой группы представляют собой бесцветные ионные кристаллическое вещества. В окрашенных солях цвет зависит от аниона. Например, в хромате калия K2CrO4 и перманганате калия KMnO4 хромофорами являются хромат- и перманганат-ионы CrO42− и MnO4−.
Большинство солей, содержащих катионы первой группы, хорошо растворимы в воде. Известно лишь несколько солей, обладающих малой растворимостью. Они используются в анализе для осаждения и открытия катионов K+, Na+ и NH4+. К таким соединениям относятся гидротартрат
калия KHC4H4O6, гексанитрокобальтат (III) калия – натрия K2Na[Co(NO2)6] и гексагидроксостибиат (V) натрия Na[Sb(OH)6].
Очень важно, что соли аммония в отличие от солей калия и натрия разлагаются при нагревании и, следовательно, могут быть удалены прокаливанием:
NH4Cl → t HCl↑ +NH3 ↑
Все соли аммония легко гидролизуются, тогда как из солей калия и натрия подвергаются гидролизу только соли слабых кислот (угольной, уксусной и др.).
Группового реагента, осаждающего все три катиона первой группы, не имеется.
Объяснение: