Теорія електролітичне дисоціації (Тед)
Електролітами називають речовини, водні розчини або розплави яких проводять електричний струм
Атоми і групи атомів, що несуть електричний заряд, називають іонами. Позитивно заряджені іони називають катіонами, негативно заряджені іони - аніонами
Процес розпаду речовини на іони при розчиненні у воді або розплавлення називають електролітичної дисоціацією
Електролітична дисоціація складається з двох одночасно протікаючих зворотних процесів: з дисоціації (розпад молекул на іони) і асоціації (процес утворення молекул з іонів). Тому в рівнянні електролітичноїдисоціації завжди ставлять знак зворотного протікання⇔
У водних розчинах дисоціації схильні кислоти, сильні підстави і розчинні солі
Приклад:
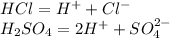
В сульфите натрия сера имеет промежуточную степень окисления S⁺⁴, поэтому данное вещество может проявлять окислительно-восстановительную двойственность; в азотной кислоте атом азота имеет максимальную степень окисления N⁺⁵, поэтому азотная к-та будет проявлять только окислительные свойства, такие же свойства будет проявлять и дихромат калия, т.к. атом хрома имеет максимальную степень окисления Cr⁺⁶; в фосфине атом фосфора имеет минимальную степень окисления Р⁻³, поэтому фосфин будет проявлять восстановительные свойства.
Кислота H3PO4 - трехосновная, и атомы водорода могут замещаться на металл по одному( в зависимости от концентрации кислоты) -чем больше содержание кислоты тем более кислые соли образуются.
Здесь кислота в избытке( 2 моля на 1 моль щелочи), поэтому замещается один атом Н.
В случае соотношения 1:1, замещается 2 Н
Ca(OH)2+H3PO4=Ca(HPO4)+2H2O
В случае избытка щелочи - образуется средняя соль
3Ca(OH)2+2H3PO4=Ca3(PO4)2 +6H2O