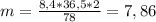 г.
г. %
%
Если мы знаем химическую формулу вещества, то достаточно рассчитать относительные массы каждого элемента в нем.
По-видимому, можно выделить два основных типа расчетных задач на основе формул химических веществ. Во-первых, зная атомные массы каждого элемента, можно вычислить их суммарную массу, приходящуюся на моль вещества, и определить процентное содержание каждого элемента. Во-вторых, можно решить обратную задачу: найти химическую формулу по заданному процентному содержанию элементов в веществе (на основании данных химического анализа)
Рассмотрим несколько примеров.
Пример 1. Рассчитайте массовые доли в процентах каждого элемента в фосфорной кислоте.
Решение. Зная относительные атомные массы каждого элемента, вычислим их сумму для Н3РО4:
Мr(Н3Р04) = 3Ar(Н) + Ar(Р) + 4Ar(0) = 3.1 + 31 + 16.4 = 98. Тогда, например, содержание водорода равно
m(р-раHCI)=200г.
m(H₂SiO₃)=8,4г.
ω%(HCI)-?
1. 2HCI + K₂SiO₃=H₂SiO₃↓ + 2KCI
2. Определим молярную массу кремниевой кислоты и количество вещества кремниевой кислоты в 8,4г.:
M(H₂SiO₃)=2+28+48=78г./моль
n(H₂SiO₃)=m(H₂SiO₃)÷ M(H₂SiO₃)=моль
n(H₂SiO₃)=8,4г.÷78г./моль=0,1моль
3. Анализируем уравнение реакции и сопоставляем с данными:
а) по уравнению реакции из 2моль соляной кислоты образуется 1молькремниевой кислоты ;
б) по даным задачи образовалось 0,1моль кремниевой кислоты, значит соляной кислоты потребуется 0,2моль.
n(HCI)=0,2моль
3. Определим молярную массу соляной кислоты и ее массу количеством вещества 0,2моль:
M(HCI)= 1+35,5=36,5г./моль
m(HCI)= n(HCI)хM(HCI)
m(HCI)=0,2мольх36,5г./моль=7.3г.
4. Определим массовую долю соляной кислоты:
ω%(HCI)=m(HCI)÷m(р-ра HCI)×100%
ω%(HCI)=7,3г.÷200г.×100%=3,65%
5. ответ: массовая доля соляной кислоты в растворе 3,65%