Заранее 1)с раствором соли кcl взаимодействует выберите один ответ: a. нитрат магния b. соляная кислота c. оксид углерода (iv) d. нитрат серебра 2)какие оксиды неметаллов растворяются в атмосферной воде, становясь причиной кислотных дождей: выберите один или несколько ответов: a. so2 b. co c. so3 d. co2 e. no f. n2o g. no2 3)реагируют с образованием осадка: выберите один ответ: a. nacl + agno3 b. ca + hcl c. fe(oh)2 + kcl d. caco3 + hcl
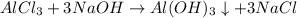 .
.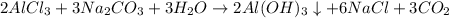 .
.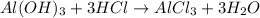 .
.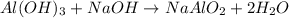 .
.![Al(OH)_{3}+NaOH\longrightarrow Na[Al(OH)_{4}]](/tpl/images/0582/2829/1ff14.png) .
.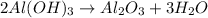 .
.
2.de
3.a(также agcl)