
1) Электролиз:
2NaBr = 2Na + Br2.
2) Это гальванический элемент Даниэля:
Две разделенные перегородкой емкости. В одной цинковый электрод, погруженный в раствор сульфата цинка, в другой - медный электрод, погруженный в раствор сульфата меди. При замыкании цепи образуется эл. ток вызванный эдс, равной примерно разности стандартных электродных потенциалов меди и цинка. (При условии примерно равной концентрации растворов сульфатов меди и цинка).
Е = Е(Cu) - E(Zn) = 0,337 - (-0,763) = 1,1 В.
Формула окислительно-восстановительной реакции:
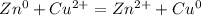
3) Уравнения гидролиза CH3COOK:
В молекулярной форме:
CH3COOK + H2O = CH3COOH + KOH.
В полной йонной форме:
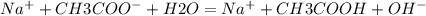
В сокращенной ионной форме:

Слабая кислота и сильное основание дают щелочную реакцию с pH>7.
4) По определению молярности раствора:
0,2 = m/(M*V), где m - искомая масса соли, M = M(NaNO3) = 85 г/моль,
V = 400 мл = 0,4 л.
m = 0,2*0,4*85 = 6,8 г
ответ: 6,8 г.
5) 4H2O2 + 4KMnO4 = 4MnO2 + 4KOH + 5O2 + 2H20
Перманганат(MnO4^(-1)) выступает в роли окислителя, а конкретно - марганец. Он принимает 3 электрона и степень окисления становится (+4)
Mn(+7) + 3e = Mn(+4)
Еще в роли окислителя выступают два иона ОН в перекиси водорода:
2ОН(0) + 2е = 2ОН(-1)
Кислород восстановитель
2О(-2) - 4е = О2(0)
Теперь выставляем коэффициенты по диагонали, делая электронный баланс. Перед свободным кислородом ставим коэффициент (3+2) = 5, а перед перекисью и марганцовкой ставим по 4. Остальные коэффициенты получаются автоматически.
1.
Дано:
m(раствораH₂SO₄)=200г.
ω%=10%
Vm=22,4л./моль
V(H₂)-?
1. Определим массу серной кислоты в 200г. ее 10% раствора:
m(H₂SO₄)=ω%xm(раствораH₂SO₄)÷100%
m(H₂SO₄)=10%×200г.÷100%=20г.
2. Определим молярную массу серной кислоты и ее количество вещества в 20г.:
M(H₂SO₄)=98г./моль
n₁(H₂SO₄)=m(H₂SO₄)÷M(H₂SO₄)=20г.÷98г./моль=0,2моль
3. H₂SO₄+Zn=ZnSO₄+H₂
по уравнению реакции:
n(H₂SO₄)=1моль n(H₂)=1моль
по условию задачи:
n₁(H₂SO₄)=0,2моль n₁(H₂)=0,2моль
4. Определим объем водорода количеством вещества 0,2моль:
V(H₂)= n₁(H₂)xVm
V(H₂)=0,2мольх22,4л./моль=4,48л.
5. ответ: образуется 4,48л. водорода при взаимодействии цинка с 200г 10% раствора серной кислоты.
2.
Дано:
m(раствораCuSO₄)=160кг.
ω%=10%
m(Fe)=12кг.
m(Cu)-?
1. Определим массу сульфата меди в 160кг. ее 10% раствора:
m(СuSO₄)=ω%xm(раствораCuSO₄)÷100%
m(CuSO₄)=10%×160г.÷100%=16кг.
2. Определим молярную массу сульфата меди и ее количество вещества в 16кг.:
M(CuSO₄)=160кг./кмоль
n₁(CuSO₄)=m(CuSO₄)÷M(CuSO₄)=16кг.÷160кг./кмоль=0,1кмоль
3. Оапределим молярную массу железных опилок и их количество вещества в 12кг.:
M(Fe)=56кг./кмоль
n₁(Fe)=m(Fe)÷M(Fe)=12кг÷56кг./кмоль=0,2кмоль
4. CuSO₄+Fe=FeSO₄+Cu
по уравнению реакции:
n(CuSO₄)=1кмоль n(Fe)=1кмоль
по условию задачи:
n₁(CuSO₄)=0,1кмоль n₁(Fe)=0,2кмоль
Железные опилки даны в избытке. Решаем задачу используя количество вещества сульфата меди:
по уравнению реакции:
n(CuSO₄)=1кмоль n(Cu)=1кмоль
по условию задачи:
n₁(CuSO₄)=0,1кмоль n₁(Cu)=0,1кмоль
5. Определим молярную массу меди и ее массу количеством вещества 0,1кмоль:
M(Cu)=64кг./кмоль
m(Cu)=n₁(Cu)xM(Cu)
m(Cu)=0,1кмольх64кг./кмоль=6,4кг.
7. ответ: при взаимодействии 60 кг 10%раствора сульфата меди с 12 кг. железных опилок выделилось 6,4кг. меди.