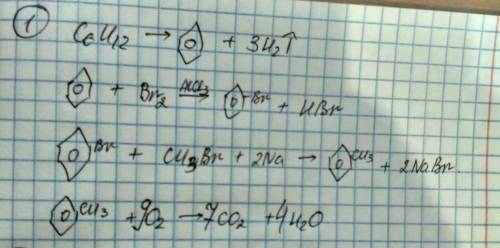
Объяснение:
1) H₂SO₄ + Na₂O → Na₂SO₄ + H₂O - молекулярное уравнение.
2) H₂SO₄ + Fe → FeSO₄ + H₂↑ - молекулярное уравнение.
2H⁺ + SO₄²⁻ + Fe → Fe²⁺ + SO₄²⁻ + H₂↑ - полное ионное уравнение.
2H⁺ + Fe → Fe²⁺ + H₂↑ - краткое ионное уравнение.
3) H₂SO₄ + Ca(OH)₂ → CaSO₄ + 2H₂O - молекулярное уравнение.
Если учитывать, что Ca(OH)₂ и CaSO₄ - растворимы, то:
2H⁺ + SO₄²⁻ + Ca²⁺ + 2OH⁻ → Ca²⁺ + SO₄²⁻ + 2H₂O - полное ионное.
2H⁺ + 2OH⁻ → 2H₂O - краткое ионное (коэффициентами не сокращены).
H⁺ + OH⁻ → H₂O - краткое ионное (коэффициентами сокращены)
4) H₂SO₄ + Ba(NO₃)₂ → 2HNO₃ + BaSO₄↓ - молекулярное уравнение.
2H⁺ + SO₄²⁻ + Ba²⁺ + 2NO₃⁻ → 2H⁺ + 2NO₃⁻ + BaSO₄↓ - полное ионное.
SO₄²⁻ + Ba²⁺ → BaSO₄↓ - краткое ионное
Объяснение:
Амфотерные соединения - это те которые обладают двойственными свойствами. В школьной химии мы говорили о основных и кислотных оксида.
Кислотные оксиды соответствуют кислотам и вступают в реакции с основаниями (щелочами)
Основные оксиды соответствуют основаниям и вступают в реакции
кислотами.
Амфотерные оксиды обладают свойствами как кислотных, так и основных оксидов и вступают в реакции как с кислотами, та и основаниями.
Амфотерные оксиды образуют только металлы и, как правило, в степени
окисления +3 и +4 (исключения редки).
К амфотерным оксидам относят ZnO, Al2O3, BeO, Cr2O3, PbO, SnO и
некоторые другие оксиды. Иногда к амфотерным оксидам относят и оксид меди (II), но амфотерные свойства этого оксида выражены очень слабо и его следует относить к основным оксидам. Химическая связь в амфотерных оксидах является промежуточной между ионной связью и ковалентной
связью.
Разберем амфотерные свойства оксида алюминия
1) Взаимодействие оксида алюминия с соляной кислотой:
Аl2O3 + 6HCl = 2AlCl3 + 3H2O
амфотерный кислота соль вода
оксид
2) Взаимодействие оксида алюминия с гидроксидом натрия
сплавление
Аl2O3 + 2 NaOH >2 NaAlO2 + Н20
амфотерный основание cоль вода
оксид
Назовем полученную соль - метаалюминат натрия
Рассмотрим еще один амфотерный оксид - оксид цинка ZnO
1) Взаимодействие оксида цинка с соляной кислотой:
ZnО + 2HCl = ZnCl2 + H2O
амфотерный кислота соль вода
оксид
2) Взаимодействие оксида цинка с гидроксидом натрия
сплавление
ZnO + 2 NaOH > Na2ZnO2 + Н20
амфотерный основание cоль вода
оксид
Назовем полученную соль - метацинкат натрия