В центре атома находитсяm положительное ядро. Вокруг вращается отрицательно заряженный электрон. Электронная формула:1s1.m прот. = 1,00783 (а.е.м.). m нейтр.= 1,00866 (а.е.м.). m протона = m электрона.
Для водорода более характерны соединения, в которых он проявляет положительную степень окисления. Он взаимодействует со многими неметаллами. В зависимости от активности неметаллов реакция может протекать с различной скоростью. Так, со фтором водород взаимодействует всегда со взрывом:F2 + H2 = 2 НF {фтороводород) Хлор взаимодействует с водородом значительно спокойнее: в темноте и без нагревания реакция протекает довольно медленно, на свету - значительно быстрее, а при наличии инициатора (искра, нагревание) - моментально и со взрывом. Поэтому смесь хлора и водорода является гремучей и требует чрезвычайной осторожности в обращении. Водород хорошо горит в атмосфере хлора. Во всех случаях реакция водорода с хлором протекает по уравнениюН2 + Сl2 = 2 НСl (хлороводород) С бромом и иодом водород реагирует очень медленно.
С другими неметаллами водород реагирует либо при высокой температуре, либо при высоких. температуре и давлении. Например, с серой водород реагирует только при нагревании, а с азотом - при нагревании и высоком давлении:Н2 + S = Н2S (сероводород )3 H2 + N2 = 2 NН3 (аммиак) Водород может отнимать кислород или галогены от многих металлов и неметаллов. В этом случае он выступает как восстановитель:
СuСl2 + Н2 = Сu + 2 НСl Эти реакции используются в металлургии для получения свободных металлов. Они, как правило, протекают при высоких температурах. Чем активнее металл, тем более высокая температура требуется для его восстановления. Водород не поддерживает горение обычных горючих веществ (являющихся соединениями углерода). Так, зажжённая свеча гаснет в нём. Однако, например, кислород горит в атмосфере водорода. Отсюда видна относительность понятия "поддерживает" или "не поддерживает" горения. Обычно его относят именно к горению соединений углерода.
Сам водород горит и в чистом кислороде, и на воздухе, причём продуктом сгорания является вода. При поджигании смеси обоих газов ("гремучего газа") взаимодействие протекает со взрывом. Если вместо поджигания привести эту смесь в соприкосновение с очень малым количеством мелко раздробленной платины (играющей роль катализатора), то реакция протекает быстро, но спокойно.
Атом водорода имеет простое строение: состоит из ядра (протон), и 1-го электрона, который находится на 1S - орбитали. Такое строение обуславливает специфические свойства водорода: у него всего лишь 1 валентный электрон, поэтому для устойчивой оболочки ему не хватает 1-го электрона. Это обуславливает его особое положение в периодической системе Д.И. Менделеева: он как щелочные металлы имеет 1 электрон на внешнем уровне, и как галогены – бинарный газ, имеющий 1 неспаренный электрон:
H0 – 1е = H+
Связь-ковалентно неполярная.
Изотопы: Протий, Дитерий, Тритий.
физические св-во.
Газ, безцветный, без запаха т.кип. -253градусов цельсия, почти не расстворим в воде, легче воздуха.
хим.св-ва.
восстановительные св-ва: с неметаллами
2Н2+О2=2Н2О
3Н2+N2=2NH3
окислительно восстановительные : с щелочами и щелочноземельными металлами: H2+2LI=2LIH
Разложение гашеной извести: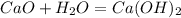
Если тепловой эффект разложения гашеной извести составляет 108кДж/моль, а по условию было использовано 81 кДж, то в реакцию вступило 0,75 моль гашеной извести и было получено 0,75 моль СаО и 0,75 моль воды (что равно 18*0,75=13,5 г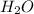 )
)
В следующую реакцию - реакцию взаимодействия негашеной извести СаО с раствором фосфорной кислоты: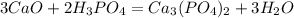 вступило 0,1*147=14,7 г фосфорной кислоты
вступило 0,1*147=14,7 г фосфорной кислоты 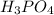 .
.
Молярная масса фосфорной кислоты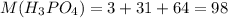 г/моль .
г/моль .
Тогда в реакцию вступило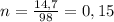 моль фосфорной кислоты и 0,225 моль негашеной извести и получилось 0,075 моль фосфата кальция.
моль фосфорной кислоты и 0,225 моль негашеной извести и получилось 0,075 моль фосфата кальция.
При этом в растворе осталось 0,75-0,225=0,525 моль или 0,525*56 =29,4г СаО, а также 13,5 + 147*0,9 =145,8 г воды.
Молярная масса фосфата кальция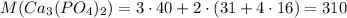 г/моль
г/моль
Тогда масса получившейся соли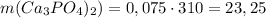 г.
г.
Масса раствора равна 23,25+145,8 + 29,4 = 198,45 г,
а массовая доля соли составляет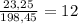 %
%