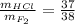Объяснение:
Из справочника найдем, что раствор азотной кислоты плотностью 1,430 г/см³ имеет молярную концентрацию 16,8 моль/л, примем его объем за V₂, а концентрацию за С₂. Фактор эквивалентности азотной к-ты равен 1, это значит, что молярная концентрация равна нормальной.
Задачу можно решить в одно действие:
V₁/V₂ = C₂/C₁
V₂ = 500*0.1/16.8 = 2,976 мл
V(H₂O) = 500 мл - 2,976 мл = 497,024 мл
ответ: Чтобы приготовить 500 мл 0,1н р-ра азотной к-ты, необходимо взять 2,976 мл азотной к-ты плотностью 1,430 г/см³ и раствор довести до 500 мл, добавив воду объемом 497,024 мл.
Нижняя задача.
При одинаковых условиях 1 моль любого газа занимаем один и тот же объем. Поэтому, если объемы образцов равны, то равно и количество молей HCl и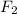 .
.
Масса вещества равна: m=Mn, где M - молярная масса, а n - количество вещества.
Отношение масс HCl и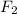 :
: 
Т.к. количество молей HCl и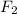 одинаково, соотношение масс равно соотношению молярных масс и равно
одинаково, соотношение масс равно соотношению молярных масс и равно