ответ: 2,24 л
Объяснение:
NaHCO3 + HCl = NaCl + H2O + CO2↑
m(HCl) = 7,3г
M(HCl) = 36,5 г/моль
m(NaHCO3) = 8,4г
M(NaHCO3) = 84 г/моль
Vм = 22,4 л/моль- постоянное число, молярный объём
n(HCl) = m/M = 0,2 моль
n(NaHCO3) = m/M = 0,1 моль
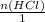 = 0,2 >
= 0,2 > 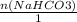 = 0,1 моль
= 0,1 моль
значит, считаем по NaHCO3
n(CO2) = n(NaHCO3) = 0,1 моль
V(CO2) = n*Vм = 0,1 * 22,4 = 2,24 л
Если даны массы нескольких исходных веществ, то расчет по уравнению реакции проводят по тому из веществ, которое находится в недостатке, т.е. первым заканчивается в реакции.
Для того, чтобы узнать, какое из веществ находится в недостатке, сравнивают их относительные количества, т.е. количества, деленные на соответствующие коэффициенты в уравнении реакции.
Амфотерность проявлять как кислотные свойства, так и основные свойства. Конкретное поведение амфотерного вещества зависит от того, с чем оно реагирует. С кислотами и кислотными оксидами амфотерное вещество проявляет основные свойства, и наоборот, с основаниями и основыми оксидами – кислотные свойства.
Важный момент. Амфотерность веществ позволяет им проявлять сразу два противоположных свойства, однако при этом оба свойства слабы. Соответственно, свои свойства амфотерные вещества обычно проявляют только с сильными реагентами: сильными кислотами и их ангидридами, а также с щелочами и их оксидами.
Кислотные свойства амфотерных гидроксидов
При сплавлении амфотерных гидроксидов с щелочами образуются смешанные окислы (соли, в которых анион образован амфотерным оксидом):
Al(OH)₃ + KOH(расплав) →t°→ KAlO₂ + 2H₂O
Fe(OH)₃ + NaOH(расплав) →t°→ NaFeO₂ + 2H₂O
Be(OH)₂ + 2NaOH →t,сплав→ Na₂BeO₂ + 2H₂O
Аналогично происходит сплавление с щелочными оксидами, но реакция возможна лишь в сухой атмосфере.
Аналогично происходит сплавление с щелочными оксидами, но реакция возможна лишь в сухой атмосфере.При растворении амфотерных гидроксидов в горячей концентрированной щелочи без плавления, образуются гидроксокомплексы
Al(OH)₃ + KOH(конц) → K[Al(OH)₄]
Zn(OH)₂ + 2KOH(конц) → K₂[Zn(OH)₄]
Cr(OH)₃ + 3NaOH → Na₃[Cr(OH)6]
Без плавления вода не выпаривается и остается связанной в молекуле продукта
Так как кислотные свойства гидроксидов слабы, реакция хорошо идет лишь с сильными основаниями – щелочами.
Реакции амфотерных металлов с щелочами
Амфотерные металлы в расплавах щелочей образуют смешанные окислы и водород:
Zn + 2KOH(расплав) → K₂ZnO₂ + H₂↑
Уравнять реакцию с алюминием невозможно без выделения оксида, как побочного продукта
2Al + 6NaOH(расплав) → 2NaAlO₂ + 2Na₂O + 3H₂↑
На практике оксид выделяться не будет, т.к. он активно поглощает водяные пары из воздуха, образуя гидроксид.
В горячей концентрированной щелочи без плавления образуются гидроксокомплексы:
2Al + 2KOH(конц) + 6H₂O = 2K[Al(OH)₄] + 3H₂↑
Be + 2NaOH(конц) + 2H₂O = Na₂[Be(OH)₄] + H₂↑
2.Два.
3.Семь.
4.Лития(Li)
5.Алюминию (Al)
6.SiO2 (кислотный)
7.HCl
8.19
9.Ca
10.С
11.60%
12.Mg(OH)2 + 2HCl -> 2H2O + MgCl2
Mg(OH)2 + 2H^+ + 2Cl^- -> 2H2O + Mg^+2 + 2Cl^-
Mg(OH)2 + 2H -> 2H2O + Mg
(^ - знак значит пишешь заряд это над элементом типа +2 или -)
13.Если есть вопросы задавай.