Дано:
V(р-ра CaCl₂) = 150 мл
ω(CaCl₂) = 16%
ρ(р-ра CaCl₂) = 1,14 гр/мл
-----------------------------------------
Найти:
m(CaCl₂ · 6H₂O) - ?
m(H₂O необ.) - ?
1) Для начала мы запишем уравнение реакций, именно по такой уравнений мы будем пользоваться:
CaCl₂ + 6H₂O → CaCl₂ · 6H₂O
2) Далее находим массу у хлорида кальция:
m(р-ра CaCl₂) = V(р-ра CaCl₂) × ρ(р-ра CaCl₂) = 150 мл × 1,14 гр/мл = 171 гр
m(CaCl₂) = m(р-ра CaCl₂)×ω(CaCl₂)/100% = 171 гр × 16%/100% = 171 гр × 0,16 = 27,36 гр
3) Теперь находим количества вещества у хлорида кальция, потом воды в кристаллогидрате по уравнению реакций:
M(CaCl₂) = 40 + 35,5×2 = 40 + 71 = 111 гр/моль
n(CaCl₂) = m(CaCl₂)/M(CaCl₂) = 27,36 гр / 111 гр/моль ≈ 0,25 моль ⇒ n(H₂O) = 6n(CaCl₂) = 6×0,25 моль = 1,5 моль
4) Теперь находим массу воды:
M(H₂O) = 1×2 + 16 = 2 + 16 = 18 гр/моль
m(H₂O) = n(H₂O) × M(H₂O) = 1,5 моль × 18 гр/моль = 27 гр
5) Теперь находим массу кристаллогидрата:
m(CaCl₂ · 6H₂O) = m(CaCl₂) + m(H₂O) = 27,36 гр + 27 гр = 54,36 гр
ответ: m(H₂O) = 27 гр
m(CaCl₂ · 6H₂O) = 54,36 гр
Решено от : 
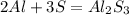
![2Al + 2NaOH + 6H_{2}O = 2Na[Al(OH)_{4}] + 3H_{2}](/tpl/images/0409/1814/9af69.png) ↑
↑![Al_{2}S_{3} + 8NaOH = 2Na[Al(OH)_{4}] + 3Na_{2}S](/tpl/images/0409/1814/93c2b.png)
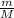
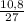 = 0,4 моль
= 0,4 моль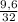 = 0,3 моль
= 0,3 моль 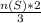 =
= 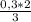 = 0,2 моль
= 0,2 моль 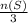 =
= 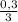 = 0,1 моль
= 0,1 моль  = 1,1 моль
= 1,1 моль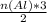 =
=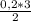 = 0,3 моль
= 0,3 моль 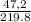 * 100% = 21,5%
* 100% = 21,5% 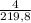 * 100% = 1,8%
* 100% = 1,8%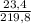 * 100% = 10,6%
* 100% = 10,6%
Mr(H2SO4) = 2Ar(H) + Ar(S) + 4Ar(O) = 2 * 1 + 32 + 4 * 16 = 98
w(H) = 2Ar(H) / Mr(H2SO4) = 2 / 98 = 0.0204 = 2.04%
w(S) = Ar(S) / Mr(H2SO4) = 32 / 98 = 0.0204 = 0.3265 = 32.65%
w(O) = 4Ar(O) / Mr(H2SO4) = 64 / 98 = 0.6531 = 65.31%
Mr(NaOH) = Ar(Na) + Ar(O) + Ar(H) = 23 + 16 + 1 = 40
w(Na) = Ar(Na) / Mr(NaOH) = 23 / 40 = 0.575 = 57.5%
w(O) = Ar(O) / Mr(NaOH) = 16 / 40 = 0.4 = 40%
w(H) = Ar(H) / Mr(NaOH) = 1 / 40 = 0.025 = 2.5%
Mr(C6H12O6) = 6Ar(C) + 12Ar(H) + 6Ar(O) = 6 * 12 + 12 * 1 + 6 * 16 = 180
w(C) = 6Ar(C) / Mr(C6H12O6) = 72 / 180 = 0.4 = 40%
w(H) = 12Ar(H) / Mr(C6H12O6) = 12 / 180 = 0.0667 = 6.67%
w(O) = 6Ar(O) / Mr(C6H12O6) = 96 / 180 = 0.5333 = 53.33%