уравнения реакций получения:
1)основного оксида:
4Na + O2 = 2Na2O
4K + O2 = 2K2O
2Ca + O2 = 2CaO
Ca(OH)2 =t C = CaO + H2O
2Ba + O2 = 2BaO
Mg(OH)2 ↓= t C = MgO + H2O
2)кислого оксида:
S + O2 = SO2
2SO2 + O2 = 2SO3
H2SO3 = H2O + SO2
CaCO3 = CaO + CO2↑
H2SiO3 = H2O + SiO2
4P + 5O2 = 2P2O5
3)амфотерного оксида:
4Al + 3O2 = 2Al2O3
2Zn + O2 = 2ZnO
6) щелочи: NaOH, KOH, LiOH,Ca(OH)2
нерастворимые: Ti(OH)3, Mg(OH)2
9) KOH + HNO3= H2O + KNO3
n=m÷M
n(HNO3) = 18,9÷63= 0,3 моль
по уравнению следует, что: n(HNO3)= n(KNO3)=0,3 моль
m=n×M
m(KNO3) = 0,3 × 101= 30,3 г
ответ:30,3г
10) из дано этот элемент щелочноземельный металл, все ЩЗМ реагируют с азотом одинаково(азот восстанавливается до -3), примем щзм за Х:
3X+N2=X3N2
n= V÷Vm
(для газов при н.у. Vm=22,4 л/моль)
n(N2) = 1,12:22,4= 0,05 моль
по уравнению реакции: 3×n(N2)= n(X)
n(X)= 0,05×3= 0,15 моль
M=m÷n
M(X)=3,6÷0,15=24г/моль => Х - это Мg
схема электронного строения на фото
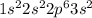
Примеры реакций в двух вариантах