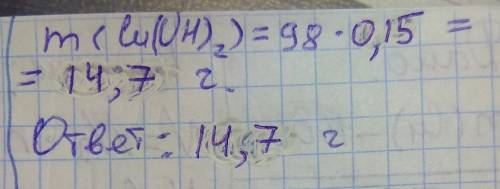

1) Гидроксид алюминия может вз-ть с соляной кислотой
Al(OH)3+3HCl = AlCl3 + 3H2O
c щелочами в р-р NaOH + Al(OH)3 = Na{Al(OH)4}
при спалавлении NaOH + Al(OH)3= NaAlO2 + 2H2O
при нагревании разлагаются 2Al(OH)3 = Al2O3+3H2O
c растворами аммиака не вз-ет
Гидроксид магния разлагается при t⁰=350C Mg(OH)2=MgO + H2O
вз-ет с кислотами Mg(OH)2+2HCL=MgCL2+H2O
вз-ет с горячими конц. р-р щелочи Mg(OH)2+NaOH=Na2{Mg(OH)4}
12 x
2) 2NaOH+CuCl2=2NaCL+Cu(OH)2
40 98 x=29,4 г осадка образуется
Записываем реацию образования нитрометана из простых веществ:
1) С+1.5Н2+0.5N2+O2 = СН3NО2(г) + Нобр
Записываем реакции сгорания простых веществ и нитрометана
2) Сграф + О2 = СО2 -393,795 кДж/моль
3) Н2 + 1/2О2 = Н2О(ж) -285,83 кДж/моль
4) СН3NО2 + 0,75О2 = СО2 + 0,5N2 + 1,5Н2О -708,77 кДж/моль
В любых реакицях учет стехиометрических коэффициентов ОБЯЗАТЕЛЕН иначе запись не имеет смысла.
С учетом вышесказанного комбинируем первую реакцию из других
1 = 2 + 1,5*3 - 4 = -393,8 + 1,5*(-285,83) -(-708,77) = - 113,73 кДж/мол
1 вариант
1. а - реакция соединения (2Cu + O2 = 2CuO)
б - реакция разложения (2Fe(OH)3 = Fe2O3 + 3H2O)
в - реакция обмена (2NaOH + H2SO4 = Na2SO4 + 2H2O)
г - реакция замещения (Zn + 2HCl = ZnCl2 + H2)
2. K2(+)S(+6)O4(2- )
Na2(+)C(+4)O3(2-)
K(+)Mn(+7)O4(2-)
H(+)P(+5)O3(2-)
Al2(+3)(S(+6)O4(2-))3
H(+)Cl(+7)O4(2-)
3. а - KMnO4, Сl
б - H2, H2S
4. a - MgCl2 - (Mg восстановитель, Cl окислитель)
б - Al2Se3 (Al восстановитель, Se окислитель)
в - Cl2O7 (Cl восстановитель, O окислитель)
г - PCl5 (P восстановитель, Cl окислитель)