Дано m(см) = 10г W(NaCl)=30% W(KCl)=70% найти Nсмеси-? Находим массу NaCl и KCl Пусть 100% --- 10г Тогда 30% --- ХГ х=3г NaCl 100%--10g 70%--Xg X=7g KCl определяем молекулярные массы NaCl и KCl M(NaCl)=23+35.5 =58.5g/mol M(KCl)=39+35.5=74.5g/mol зная массы и молекулярные массы находим молярные массы NaCl и KCl ню = m/M ню(NaCl)=3/58.5=0.05 mol ню(KCl) = 7/74.5=0.09 mol общее количество молей в газе равно 0.05+0.09 = 0.14 моль Определяем количество молекул в 10 гр. в смеси по формуле N=ню*Na гдеNa=6.02*10^23 N=0.14*6.02*10^23=0.84*10^23 Зная что 1г содержится 0.84*10^23 а в 10г --- Хгр Х=10*0.84*10^23 X=8.4*10^23 молекул ответ 8.4*10^23 молекул
Потребуется 146 г 20%-ной соляной кислоты.
Объяснение:
По уравнению реакции соляная кислота и гидроксид натрия реагируют в отношении 1 моль : 1 моль.
HCl + NaOH → NaCl + H₂O
Найдем количество вещества гидроксида натрия в 160 г 20%-ного раствора.
Масса гидроксида натрия в растворе: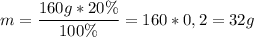 ;
;
Молярная масса M(NaOH) = 23 + 16 + 1 = 40 г/моль
Количество вещества: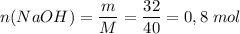
В реакцию вступило 0,8 моль гидроксида натрия и 0,8 моль соляной кислоты. Найдем массу соляной кислоты.
Молярная масса M(HCl) = 1 + 35,5 = 36,5 г/моль
Масса m(HCl) = n*M = 0,8 моль * 36,5 г/моль = 29,2 г.
⇒ В 20%-ном растворе соляной кислоты содержится 29,2 г чистого вещества HCl.
Найдем массу раствора соляной кислоты: