300000 г х л
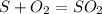
32 г 22.4 л
1. Определим наличие серы в угле:
m(S)=m(угля)*w(S)=100*0,003=0,3 т или 300 000 г
2. Подставив эту массу в уравнение реакции,получим объем оксида серы(4):
При сжигании 32 г серы образуется 22,4 л оксида, а
при -- // -- 300000 г___________х л, откуда х=300000*22,4/32=210 000 л
3. Так как из полученного объема 99% превращается на оксид серы(6),то выбросы составят 1%,т.е. сотую часть от объема образующегося оксида серы(4):
V(выбросов)=1*210000/100=2100 л или 2,1 м в кубе
х л 149 г
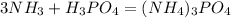
67,2 л 149 г
1. Сначала необходимо определить теоретически возможную массу ортофосфата:
111,75 г - это 75%,а
у г_________100%, откуда у=111,75*100/75=149 г
2. Подставив данную массу в уравнение,получим:
при взаимодействии 67,2 л аммиака получится 149 г аммоний ортофосфата,а
при -- // -- х л____________________149 г, откуда,глядя на пропорцию,видим,что такой же объем и необходим,т.е. 67,2 л
Атом с протонным числом 8 содержит 1 завершенный энергетический уровень.
Атом с протонным числом 9 также содержит 1 завершенный энергетический уровень.