Привет! Сейчас решим
Оксиды щелочных металлов имеют общую формулу Me2O. Составим уравнения реакции
Me2O + 2HCl = 2MeCl + H2O
Рассчитаем массу кислоты.
m(р-ра) = 278,9*1,047 = 292 г
m(HCl) = 292*0,1 = 29,2 г
Как видно из уравнения реакции, 1 моль оксида реагирует с двумя моль к-ты. Рассчитаем её количество
n(HCl) = 29,2:36,5 = 0,8 моль. Значит, n(Me2O) = 0,4 моль
m(MeO2) = 24,8 (0,4 моль). Отсюда следует, что
M(Me2O) = 24,8:0,4 = 62 г/моль. Два атома металла весят 62-16 = 46. Следовательно, M(Me) = 46:2 = 23 г/моль. Это Na - натрий
Готово! Есть вопросы? Напиши и я отвечу

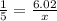
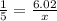
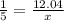
1. Zn + Cl2 = ZnCl2
2,5 моля равно кол-во цинка так как у них равны коэффициенты
2. 4Al + 3O2 = 2Al2O3
5.4/27= 0.2 моля алюминия
0.2x2/4=0.1 моль оксида алюминия
0.1x102= 10.2 гр оксида алюминия
3. 2H2+O2=2H2O
1.8/18=0.1 моль воды
0.1/2=0.05 моль кислорода так как кислород вступил в реакцию с водородом в два раза меньше
0.05х32=1.6 гр кислорода
4. Fe+CuSO4=FeSO4+Cu
11.2/56=0.2 моль железа и эта моль равен молю меди так как у них одинаковые коэффициенты
0.2 х 64=6.4 гр меди