Привіт! Зараз ми швидко усе запишемо:
1) В (за таблицею Мендлеєва)
2) Б , заряд ядра - кількістю протонів. Кількість протонів - порядковий номер.
3) Г, Кількість електронів = кількість протонів (якщо не збуджений стан)
4) А, бо більшість елементів - трьохвалентні.
5) В, Кількість електронів на зовнішньому рівні = номер групи. Калій у першій групі, тому один електрон.
6) Б, бо ці елементи - лужні метали
7) Порядковий номер = кількість електронів = 5, отже це Бор (В)
8) Б, бо стає важче утримати електрони на далеких орбіталях (тому ще й радіус також збільшується, якщо дивитись зверху вниз.
9) В, бо вони на одному енергетичному рівні.
10) Йон кальцію - Ca²⁺ має 18 електронів. Отже, наш атом має 18-3=15 електронів. Стільки має Фосфор (P), який знаходиться у 3 періоді, 5 групі головній підгрупі. Має 5 елетронів на зовнішньому рівні.
11) Перший елемент - Аl
Другий елемент - О
4 Al + 3 O₂ → 2 Al₂O₃
12) За розташуванням це Бор (В)
B₂O₃ - формула найвищого оксиду
w(E)=Ar(E)*n / Mr · 100%
w(B)=Ar(B)*2 / Mr(Br₂O₃) · 100% = 11*2 / 70 · 100% = 31.43 %
w(O)=100-31.43=68,57%
13) Формула такого оксиду R₂O₅
w(R)=Ar(R)*2 / Ar(R)*2 + Ar(O)*5 · 100%
43.46= 200x / (2x + 80)
86.92 x + 3 467,8 = 200 x
113.08 x = 3467,8
x=31
Отже це Фосфор.
Електрона конфігурація: 1s²2s²p⁶3s²p³
Готово! Є питання? Запитуйте, з радістю відповім
*Поставте найкраще, будь ласка :)
При обжиге известняка выделится 61,824 литра углекислого газа.
Объяснение:
CaCO₃ → CaO + CO₂
Если известняк содержит 8% примесей, то чистого вещества (карбоната кальция) в нем
100% - 8% = 92% (или 0,92).
Найдем массу карбоната кальция в образце:
m(CaCO₃) = 300 г · 0,92 = 276 г.
Найдем количество вещества карбоната кальция.
M(CaCO₃) = 40 + 12 + 3·16 = 100 г/моль
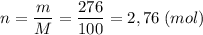
По уравнению реакции отношение количеств веществ (смотрим коэффициенты):
n(CaCO₃) : n(CO₂) = 1 : 1 = 2,76 : 2,76.
В результате реакции выделится 2,76 моль углекислого газа.
Найдем его объем:
V(CO₂) = n · Vₐ = 2,76 · 22,4 = 61,824 (л).
Ch3-ch-ch3-ch-ch3-ch2-ch2-ch3