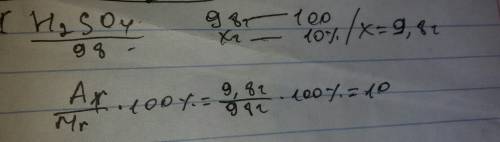
ответ: V(CO2)=14л ; m(Na2CO3)=66.25г ; m(H2O)= 11.25г
Объяснение:
Дано:
m(NaOH)= 50г
Найти: V(CO2)-? ; m(соли)-? ; m(H2O)-?
Составляем уравнение реакции. Реагирует щелочь с кислотным оксидом . В результате образуется средняя соль и вода.
2NaOH + CO2 = Na2CO3 + H2O
Находим химическое количество(моль) щелочи по её массе:
M(NaOH)=40 г/моль; n(NaOH)= m(NaOH) / M(NaOH)= 50г : 40г/моль= 1.25 моль
По уравнению реакции химическое количество углекислого газа в два раза меньше химического количества щелочи, то есть n(CO2)=1.25моль/2= 0.625 моль
Тогда объем углекислого газа V(CO2)=n(CO2)*Vm=0.625 моль * 22.4л/моль= 14л (Vm-молярный объем газа,равный 22.4 л/моль).
Аналогично по уравнению находим химические количества образовавшихся в ходе реакции соли( Na2CO3) и воды. Их количества также в 2 раза меньше, чем количество щелочи.
n(Na2CO3)=0.625 моль ; n(H2O)=0.625 моль
Найдем их массы. M(Na2CO3)=106г/моль ; M(H2O)=18г/моль
m(Na2CO3)=n(Na2CO3) * M(Na2CO3) = 0.625 моль * 106г/моль = 66.25 г ;
m(H2O)=n(H2O) * M(H2O) = 0.625 моль * 18г/моль = 11.25 г
1 задание
Листья и стебли крапивы покрыты ломкими полыми «волосками», которые действуют как иглы для внутрикожной инъекции при касании. Химические вещества растений проходят сквозь эти полые трубочки и вызывают на коже неприятное ощущение жжения и сыпь. Ожог, вызванный крапивой, достаточно болезненный, но его можно вылечить содой т.к она нейтрализует действие химических веществ
2 задание
Лакмус :
кислая среда - красный
нейтральная среда - фиолетовый
щелочная среда - синий
Фенолфталеин:
кислая среда - бесцветный
нейтральная среда - бесцветный
щелочная среда - малиновый
Метил-оранжевый:
кислая среда: красный
нейтральная среда: оранжевый
щелочная среда: желтый
кислая среда - ph<7
нейтральная - ph=7
щелочная - ph>7
3 задание
4 задание
1-с
2-d
3-b
4-а
5 задание
а-F Cl Br I
b-nS2 np3
6 задание
Ar (Br) = 80
Ar (Zn) = 65
Ar (S) = 32
Ar (Ag) = 108
7 задание
мышьяк As порядковый номер 33 , Vгруппа главная подгруппа, 4 период
Относительная атомная масса 75 а.е.м.
Строение атома- заряд +33, протонов 33, электронов 33, нейтронов
75-33=42
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3 p-элемент неметалл высшая валентность V.
степени окисления -3, 0,+3, +5, проявляет окислительные и восстановительные свойства
высший оксид As2O5
задание 8
Fe2O3
K2MnO4
9 задание
Mr (Al (OH)3) = 27 + 16*3 + 1*3 = 78 г/моль
Mr(H3PO4) = 1 • 3 + 31 + 16 • 4 = 98
10 задание
Al2S3
K3N
Объяснение:
могут быть ошибки