Было 5,0 г cuso4 • 5h2o, который впоследствии частично высох на воздухе. затем данную навеску растворили в 100 г h2o. массовая доля cuso4 в полученном растворе составила 3,069 %. найдите количество молекул воды в высушенном кристаллогидрате.
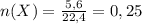 моль
моль
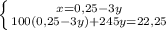
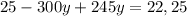

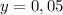
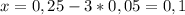
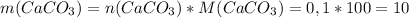 г
г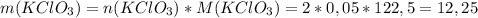 г
г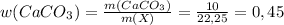 или 45%
или 45% или 55%
или 55%
m( CuSO4*5H2O)=5 г
m(H2O )=100 г
W1(CuSO4)=3,069%
CuSO4*хH2O -?
M(CuSO4)=160г/моль M(СuSO4*5H2O)=250 г/моль
w(в-ва)=m(раств.в-ва)/m(р-ра), m(в-ва)=w(раств.в-ва)*m(р-ра)
n=m/M , m=n*М
w(CuSO4)= М (CuSO4)/ М (CuSO4*5H2O)=160/250=0,64
Сколько CuSO4 в 5 г CuSO4*5H2O m CuSO4=0,64*5=3,2 г,
Масса соли не изменяется
Какая масса раствора, если доля соли 0,03069
0,03069=3,2/у
у=104,27 г
Тогда масса кристаллогидрата осталась после просушивания104,27-100=4,27 г
Сколько воды осталось в нем 4,27-3,2=1,07 г, количество n=1,07/18=0,0594 моль
Находим количество воды , оставшееся в кристаллогидрате( на 1 моль)
в 4,27 г CuSO4*хH2O содержится 1,07 г H2O .
а в (160+х) г CuSO4*хH2O будет содер. х г H2O
1,07*(160+х)=4,27х
х=53,5 г Н2О
n Н2О= 53,5/18=2,97 моль
CuSO4*3(2,97)H2O