Разница в том, что в кислотах ОН-группа прикрепилась к атому с высокой электроотрицательностью (неметаллу), а в щелочах - к атому с низкой электроотрицательностью (металлу).
В кислоте центральный атом (неметалл) прочнее связан с кислородом, чем кислород связан с водородом. В щелочи центральный атом (металл) слабее связан с кислородом, чем кислород связан с водородом.
Почему в воде кислота отдаст только протон (водород) и станет анионом, а щелочь отдаст всю ОH-группу и станет катионом.
Объяснение:
вот)
Менделеевтің периодтық заңы , периодтық заң – атом ядросы зарядтарының артуына байланысты химиялық элементтер қасиеттерінің периодты өзгеретінін тұжырымдайтын табиғаттың негізгі заңы.
Бұл заңды 1869 жылы Д.И. Менделеев ашты. Ол оның толық тұжырымдамасын 1871 жылы жариялады. Менделеевтің 1869 жылы жасаған еңбегі элементтердің периодтық жүйесі – Менделеевтің периодтық заңының графиктік бейнесі. Бұл заң элементтердің периодтық жүйесімен тығыз байланысты және бірін-бірі толықтырып, түсіндіреді. Ядроның заряды (Z) жүйедегі элементтердің атом нөміріне тең. Z өсуі бойынша орналасқан элементтер Z (Н, Нe, Lі, Be…) 7 период түзеді.
1-ші периодта – 2 элемент,
2 мен 3-те – 8-ден,
4 пен 5-те – 18-ден,
6-да – 32 элемент,
7-де – 23 элемент белгілі.
Периодта элементтердің қасиеттері сілтілік металдардан инертті газдарға өткенде заңды түрде өзгереді. Вертикальды бағаналар – қасиеттері ұқсас элементтердің топтары болып табылады. Топтың ішінде элементтердің қасиеттері де заңды түрде өзгереді (мысалы, сілтілік металдарда Lі-ден Fr-ға дейін химиялық активтілік өседі). Z=58 – 71, сол сияқты Z=90 – 103 элементтерінің қасиеттері ұқсас болғандықтан лантаноидтар және актиноидтар қатарларына топтастырылған. Элементтер қасиеттерінің периодтылығы атомның сыртқы электрон қабаттарының конфигурациясының периодты қайталануына байланысты. Ауыр ядролар тұрақсыз, мысалы, америций (Z=95) және содан кейінгі элементтер табиғатта табылмаған, оларды жасанды, ядролық реакциялар арқылы алады.
Уравнение диссоциации только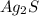 :
:
Произведение растворимости:
Отсюда находим молярную растворимость:
Растворимость, выраженная в граммах на литр:
Ионный баланс раствора, содержащего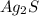 и
и 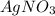 :
:
Концентрация ионов серебра определяется теперь не только количеством продиссоциировавших молекул сульфида серебра, но и концентрацией продиссоциировавших молекул нитрата серебра.
Нитрат серебра - сильный электролит, поэтому диссоциирует полностью.
Приближённо можем считать концентрацию ионов серебра равной концентрации добавленной в раствор соли. Это сильно упрощает расчёт и позволяет вычислить концентрацию сульфид-ионов: