Дано:
m₁[раствораCa(NO₃)₂]=470г.
ω₁%=19%
m₂[раствораCa(NO₃)₂]=235г.
ω₂%=25%
ω%-?
1. Определим массу нитрата кальция в растворе 1:
m₁[Ca(NO₃)₂]=ω₁%×m₁[раствораCa(NO₃)₂]÷100%
m₁[Ca(NO₃)₂]=19%×470г.÷100%=89,3г.
2.Определим массу нитрата кальция в растворе 2:
m₂[Ca(NO₃)₂]=ω₂%×m₂[раствораCa(NO₃)₂]÷100%
m₂[Ca(NO₃)₂]=25%×235г.÷100%=58,8%
3. Определим общую массу нитрата кальция :
m[Ca(NO₃)₂]=m₁[Ca(NO₃)₂]+m₂[Ca(NO₃)₂]
m[Ca(NO₃)₂]=89,3г.+58,5г.=147,8г.
4. Определим общую массу раствора нитрата кальция:
m[раствораCa(NO₃)₂]=m₁[раствораCa(NO₃)₂]+m₂[раствораCa(NO₃)₂]
m[раствораCa(NO₃)₂]=470г.+235г.=705г.
5. Определим массовую долю(концентрации % ) нового раствора нитрата кальция:
ω%=m[Ca(NO₃)₂]÷m[раствораCa(NO₃)₂]×100%
ω%=147,8г.÷705г.×100%=20,96%
6. ответ: % концентрация раствора нитрата кальция 20,96%
вот
Объяснение:
Окисно-відновні реакції — реакції, які супроводжуються переходом електронів від одних атомів, молекул або іонів до інших при зміні ступеня окиснення елементів. Речовину, що містить елемент, який віддає електрони, називають відновником. Процес віддачі електронів, при якому ступінь окиснення елемента зростає, називають окисненням. Речовину, що містить елемент, який приєднує електрони, називають окисником. Процес приєднання електронів називають відновленням. При відновленні ступінь окиснення елемента знижується. Ступінь окиснення елемента — це той електричний заряд атома цього елемента у сполуці, який розраховується, виходячи з припущення, що сполука складається з іонів. Або це той умовний заряд, який мав би атом елемента у сполуці при повному переході електронних пар, які утворюють зв’язок, до більш електронегативних атомів. Процеси окиснення та відновлення проходять одночасно і загальне число електронів, відданих відновником, дорівнює числу електронів, прийнятих окисником. У загальному вигляді О.-в.р. можна записати так: Am + Bp → Am-n + Bp+n, де: відновник: Am — nē ↔ Am-n — процес окиснення відновника; окисник: Вр + nē ↔ Bp+n — процес відновлення окисника.
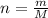 — формула кількості речовини.
— формула кількості речовини.
Знайдемо масу пропану:
m (C₃H₈) = M (C₃H₈) ∙ n (C₃H₈) = 44 ∙ 0,5 = 22 (г).
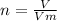 — формула кількості речовини.
— формула кількості речовини.
Vm (молярний об'єм) газів за н.у. становить 22,4 л/моль.
560 мл = 0,56 л.
Знайдемо кількість речовини етену:
n (C₂H₄) = V (C₂H₄) : Vm = 0,56 : 22,4 = 0,025 (моль).
Знайдемо масу етену:
m (C₂H₄) = M (C₂H₄) ∙ n (C₂H₄) = 28 ∙ 0,025 = 0,7 (г).
Маса метану нам вже відома за умовою.
Обчислимо масу суміші:
m (сум.) = m (C₃H₈) + m (C₂H₄) + m (CH₄) = 22 + 0,7 + 8 = 30,7 (г).
Відповідь: 30,7 г.
Дано:
m1(р-ра Ca(NO3)2)=470 г
w1(Ca(NO3)2)=19%
m2(р-ра Ca(NO3)2)=235 г
w2(Ca(NO3)2)=25%
w3(Ca(NO3)2)-?
1 При сливании двух расстворов одного вещества их массы складываются:
m1+m2=m3
470+235=705 г
2 Найдем массы веществ в каждом из расстворов:
m1(Ca(NO3)2)=470×19/100=89.3 г
m2(Ca(NO3)2)=235×25/100=58.75 г
3 При сливании они также складываются:
89.3+58.75=148.05 г
4 Получается расствор с некой концентрацией чистого вещества. Найдем его процентное содержание в растворе:
w3(Ca(NO3)2)=(148.05/705)×100%=21%
ответ: 21%