1) CH₂=CH₂ + Br₂  Br-CH₂-CH₂-Br (или C₂H₄Br₂) - 1,2-Дибромэтан
Br-CH₂-CH₂-Br (или C₂H₄Br₂) - 1,2-Дибромэтан
2) C₂H₄ + 3O₂  2CO₂ + 2H₂O - Углекислый газ и вода
2CO₂ + 2H₂O - Углекислый газ и вода
3) C₂H₆ 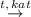 C₂H₄ + H₂ - Этилен
C₂H₄ + H₂ - Этилен
4) С₂H₂ + 2Br₂  CHBr₂-CHBr₂ - 1,1,2,2-Тетрабромэтан
CHBr₂-CHBr₂ - 1,1,2,2-Тетрабромэтан
Применение этена
Основное направление использование этилена — промышленный органический синтез таких соединений как галогенопроизводные, спирты (этанол, этиленгликоль), уксусный альдегид, уксусная кислота и др. Кроме этого данное соединение в производстве полимеров.
Гидрирование, получение этана:
CH₂=CH₂ + H₂→ CH₃-CH₃ (kat = Pt).
Галогенирование, получение галогенопроизводных:
CH₂=CH₂ + Br₂→ BrCH-CHBr.
Гидратация, получение этилового спирта:
CH₂=CH₂ + H-OH → CH₃-CH-OH (H+, t°).
Полимеризация, получение полимеров:
nCH₂=CH→ -[-CH₂-CH₂-]-n (kat, t°).
Окисление получение мнгоатомного спирта- этиленгликоля, простых эфиров:
CH₂=CH₂ + 2KMnO₄ + 2KOH → HO-CH₂-CH₂-OH + 2K₂MnO₄;
2CH₂=CH₂ + O₂ → 2C₂OH₄ (эпоксид) (kat = Ag,t°);
Горение получение тепла: C₂H₄ + 2O₂→ 2CO₂ + 2H₂O+Q
1) После испарения воды массовая доля вещества станет 25 + 5 = 30%
2) Обозначим массу выпаренной воды через Х грамм
3) Если концентрация раствора выражена в долях единицы, то массу растворенного вещества в граммах находят по формуле:
m(в-во) = ω * m(p-p)
где: m(p-p) - масса раствора в граммах, ω - массовая доля растворенного вещества, выраженная в долях единицы.
Так как масса растворенного вещества остается неизменной, то можно записать уравнение:
0,25*300 = 0,3*(300 - Х)
75 = 90 - 0,3Х
0,3Х = 15
Х = 50
ответ: 50 г воды
2. не помню. (углекислый
газ и вода)
3.этилен.
4.Соеденение с 4 атомами брома в молекуле.
Удачи)