1. Процесс взаимодействия уксуса с пищевой содой
является Химическим явлением - верно
CH3-COOH + NaHCO3 => CH3-COONa + H2O + CO2
образуется ацетат натрия, вода и углекислый газ
2. Химические свойства соды: белое кристаллическое
вещество без запаха - верно
3. Физические свойства уксуса: бесцветная жидкость с характерным запахом, кислым вкусом - верно
4. Пищевая сода претерпевает химические изменения при растворений В воде - верно
На самом деле при растворении пищевой соды в воде происходит электролитическая диссоциация - процесс распада цельной молекулы соды (NaHCO3) на ионы. Это происходит из-за того, что молекула воды полярна, с разных концов она имеет преимущественно "+" или "-", поэтому и растаскивают такие молекулы воды разнозаряженные ионы соды
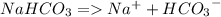
PS.: Вполне явным доказательством того, что процесс именно химической (электрохимический, если точно) - на мой взгляд служит факт того, что
- ни чистая вода, ни сода в чистом виде не проводят электроток
- раствор же соды в воде ток проводит
93,90%
Объяснение:
Запишем уравнение реакции:
Al(OH)3+3HNO3=Al(NO3)3+3 H2O
Вычислим молярную массу гидроксида алюминия
Mr(Al(ОН)3)=27+3*(1+16)=78 г/моль
Вычислим количество вещества гидроксида алюминия, вступившего в реакцию:
n(Al(OH)3)=m(Al(OH)3)/Mr(Al(OH)3)=117/78=1,5 моль
По уравнению реакции, можем составить пропорцию:
из 1 моль Al(OH)3 получается 1 моль Al(NO3)3
из 1,5 моль Al(OH)3 получается Х моль Al(NO3)3
Отсюда Х=1,5*1/1=1,5 моль Al(NO3)3
Вычислим молярную массу гидроксида алюминия
Mr(Al(NO3)3)=27+3*(14+3*16)=213 г/моль
Вычислим сколько теоретически должно получится нитрата алюминия:
m(теоретич)(Al(NO3)3)=n(Al(NO3)3)*Mr(Al(NO3)3)=213*1,5=319,5 грамм
Массовую долю выхода найдем по формуле:
w=(m(практ)/m(теорет))*100%=300/319,5*100%=93,90%