ответ: 73,8г
Объяснение:
Дано:
V(р-ра)=300мл
ω=20% = 0,2
ρ=1,23г/мл
найдем массу раствора
1)ρ=m/V
m=ρ*v
m(р-ра)= 1,23г/мл * 300мл = 369г
нахожу массу сахара
ω= m(в-ва)/m(смеси)
m(в-ва)= m(смеси) * ω
2) m(сахара) = 369г * 0,2 = 73,8г
ответ: 73,8г
Для этого достаточно добавить в каждую пробирку с веществами один реактив - серную кислоту:
Если в одной из пробирок увидите вскипание массы и услышите шипение,что свидетельствует о выделении газа,то в это раствор карбоната,потому что в результате образуется не стойкая угольная кислота,которая тут же разлагается на воду и углекислый газ(отсюда и шипение,и вскипание массы):
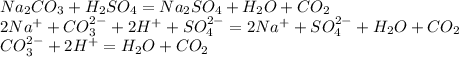
Если выпадет в какой либо иной пробирке студенистый осадок,то это раствор силиката натрия,потому что образуется нерастворимая кремниевая кислота,которая и выпадает в осадок:
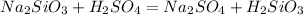 - осадок
- осадок
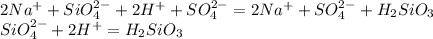
А в третьей пробирке никаких визуальных изменений не произойдет,значит это остался сульфат натрия
1) 13,44 л
2) 9,6 г
Объяснение:
1) Формула: 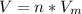 , где n - количество вещества (моль);
, где n - количество вещества (моль); 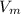 - молярный объем, который для всех газов при нормальных условиях равен 22,4 л/моль
- молярный объем, который для всех газов при нормальных условиях равен 22,4 л/моль
Подставляем и решаем: 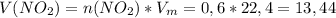 л
л
2) Формула количества молекул: 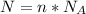 , где N - число молекул; n - количество вещества (моль);
, где N - число молекул; n - количество вещества (моль); 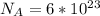 - число Авогадро (1/моль).
- число Авогадро (1/моль).
Из этой формулы нужно найти количество вещества → 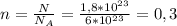 моль
моль
Далее используем формулу: 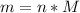 , где M - молярная масса вещества (г/моль)
, где M - молярная масса вещества (г/моль)
Молярная масса считается как сумма атомных масс элементов, входящих в вещество. Атомные массы даны в таблице Менделеева.
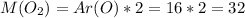 г/моль
г/моль
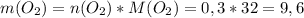 г
г
m(ppa)=VP=300×1,23=369г
m(сахара)=369×0,2=73,8г
m(H2O)=369-73,8=295,2г