Объяснение:
бмен веществ в организме можно определить как совокупность всех химических превращений, которым подвергаются соединения, поступающие извне. Эти превращения включают все известные виды химических реакций: межмолекулярный перенос функциональных групп, гидролитическое и негидролитическое расщепления химических связей, внутримолекулярная перестройка, новообразование химических связей и окислительно - восстановительные реакции. Такие реакции протекают в организме с чрезвычайно большой скоростью только в присутствии катализаторов. Все биологические катализаторы представляют собой вещества белковой природы и носят названия ферменты (далее Ф) или энзимы (Е).
Ферменты не являются компонентами реакций, а лишь ускоряют достижение равновесия увеличивая скорость как прямого, так и обратного превращения. Ускорение реакции происходит за счет снижении энергии активации – того энергетического барьера, который отделяет одно состояние системы (исходное химическое соединение) от другого (продукт реакции).
Ферменты ускоряют самые различные реакции в организме. Так достаточно простая с точки зрения традиционной химии реакция отщепления воды от угольной кислоты с образованием СО2 требует участия фермента, т.к. без него она протекает слишком медленно для регулирования рН крови. Благодаря каталитическому действию ферментов в организме становится возможным протекание таких реакций, которые без катализатора шли бы в сотни и тысячи раз медленнее.
Свойства ферментов
1. Влияние на скорость химической реакции: ферменты увеличивают скорость химической реакции, но сами при этом не расходуются.
Скорость реакции – это изменение концентрации компонентов реакции в единицу времени. Если она идет в прямом направлении, то пропорциональна концентрации реагирующих веществ, если в обратном – то пропорциональна концентрации продуктов реакции. Отношение скоростей прямой и обратной реакций называется константой равновесия. Ферменты не могут изменять величины константы равновесия, но состояние равновесия в присутствии ферментов наступает быстрее.
2. Специфичность действия ферментов. В клетках организма протекает 2-3 тыс. реакций, каждая из которые катализирутся определенным ферментом. Специфичность действия фермента – это ускорять протекание одной определенной реакции, не влияя на скорость остальных, даже очень похожих.
Различают:
Абсолютную – когда Ф катализирует только одну определенную реакцию (аргиназа – расщепление аргинина)
Относительную (групповую спец) – Ф катализирует определенный класс реакций (напр. гидролитическое расщепление) или реакции при участии определенного класса веществ.
Специфичность ферментов обусловлена их уникальной аминокислотной последовательностью, от которой зависит конформация активного центра, взаимодействующего с компонентами реакции.
Вещество, химическое превращение которого катализируется ферментом носит название субстрат (S).
3. Активность ферментов в разной степени ускорять скорость реакции. Активность выражают в:
1) Международных единицах активности – (МЕ) количество фермента, катализирующего превращение 1 мкМ субстрата за 1 мин.
2) Каталах (кат) – количество катализатора (фермента превращать 1 моль субстрата за 1 с.
3) Удельной активности – число единиц активности (любых из вышеперечисленных) в исследуемом образце к общей массе белка в этом образце.
4) Реже используют молярную активность – количество молекул субстрата превращенных одной молекулой фермента за минуту.
Активность зависит в первую очередь от температуры. Наибольшую активность тот или иной фермент проявляет при оптимальной температуре. Для Ф живого организма это значение находится в пределах +37,0 - +39,0 °С, в зависимости от вида животного. При понижении температуры, замедляется броуновское движение, уменьшается скорость диффузии и, следовательно, замедляется процесс образования комплекса между ферментом и компонентами реакции (субстратами). В случае повышения температуры выше +40 - +50 °С молекула фермента, которая является белком, подвергается процессу денатурации. При этом скорость химической реакции заметно падает (рис. 4.3.1.).
переведем температуры в кельвены(по системе си) T1=10+273=283 K температура холодной воды по Кельвену и T2=60+273=333 К температура горячей
Q=cm(T2-T1)
Q-количество теплоты нужное для изменения температуры на (Т2-Т1) кельвинов(или градусов) теплоемкостью c
c- удельная теплоемкость воды(4200 дж/кг*К)
формула которую будем использовать.
ванна 200 л, холодная 50 л => горячая 200-50=150 лт. у воды л=кг. т.е холодной воды 50 кг, горячей 150 кг.
Холодная вода берет тепло Q=c*m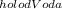 *(T3-T1)
*(T3-T1)
горячая отдает тепло Q= c*3m*(T2-T3)
3m - потому что горячей воды в 3 раза больше
T3 - та температура что установится в ванне, испоьзуем ур теплоты для хол и гор воды
c*m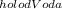 *(T3-T1)=c*3m*(T3-T2)
*(T3-T1)=c*3m*(T3-T2)
с и m сокращаются
T3-T1=3*(T2-T3)
T3=(T2*3+T1)/4=(333*3+283)/4=320.5 К в градусах 320.5-273=47.5