Объяснение:
в изобарном процессе газ переходит из состояния p V₁ в состояние p V₂ при этом газом выполняется работа A=p*(V₂-V₁)=v*R*ΔT
изменение внутренней энергии одноатомного идеального газа при нагревании на ΔT равно ΔU = ³/₂*v*R*ΔT
полное количество пjдведенной теплоты равно Q = A+ΔU=⁵/₂*v*R*ΔT
получаем следующее распределение подведенной теплоты
Q : ΔU : А = ⁵/₂ : ³/₂ : ²/₂= 5 : 3 : 2
на увеличение внутренней энергии уходит ³/₅ подведенного тепла (60%)
на выполнение работы газом уходит ²/₅ подведенного тепла (40%)
Объёмы горячей и холодной воды: V₁ = V₂ = V = 3 л = 3 * 10⁻³ м³.
Температура горячей воды (кипения воды): t₁ = 100 °C.
Температура холодной воды: t₂ = 15 °C.
Найти изменение температуры горячей воды Δt₁ - ?Решение:0. Тепло, полученное от остывания кипятка тратится на нагревание холодной воды. В итоге устанавливается общая температура t.
1. Сразу найдём массу воды: m₁ = m₂ = m = ρV = 1000 * 3 * 10⁻³ = 3 (кг) (на самом деле она нам нужна, почему - узнаете далее).
2. Запишем уравнение теплового баланса: cm(t₁ - t) = cm(t - t₂).
3. Сократим на c и m и (огого!) масса нам больше не нужна: t₁ - t = t - t₂.
4. Выразим общую конечную температуру:
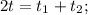
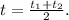
5. Тогда изменение температуры горячей воды:

 (°C).
(°C).
Объяснение:
Запишем закон сохранения импульса в виде:
F·Δt = m·ΔV;
F = (m/Δt)·ΔV = (1,5/1)·200 = 300 Н.