375,3 К или 102,3 оС
Объяснение:
Уравнение состояния идеального газа - это уравнение Менделеева-Клапейрона PV=vRT.
По условию дано два состояния
P1*V1=v*R*T1 (1)
P2*V2=v*R*T2 (2)
Выразим из первого ур-я начальную (неизвестную) температуру
T1=/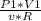 (3)
(3)
Заметим, что произведение количества вещества на газовую постоянную v*R будет одинаковым и в первом и во втором уравнении.
выразим из второго уравнения это произведение
v*R=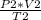 .
.
Подставим в v*R (3).
Окончательная формула
T1=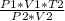 =
=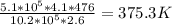
ответ: 375,3 К или (375,3-273) 102,3 град. Цельсия
Число электронов:
Nэ = 3·10²³
Объяснение:
Найти количество N электронов, которые содержатся в кусочке углерода массой m=1 г. Масса одного моля углерода М=12 г. Порядковый номер углерода в таблице Менделеева Z=6.
Дано:
m = 1 г
M = 12 г / моль
Z = 6
Nₐ = 6,02·10²³ моль⁻¹ - постоянная Авогадро
Nэ- ?
Количество вещества:
ν = m/M (1)
Но:
ν = N / Nₐ (2)
Приравняем (2) и (1):
N / Nₐ = m/M
Тогда число атомов углерода:
N = (m/M)·Nₐ
N = (1/12)·6,02·10²³ ≈ 5·10²²
Поскольку у атома углерода n=6 электронов, то общее число электронов:
Nэ = n·N = 6·5·10²² = 3·10²³
h(max)=(U(y)* U(y)-U(0y)* U(0y))/2g(y)=(0-U(0)*sinA * U(0)*sinA)/-2g= (U(0)*sinA * U(0)*sinA)/2g
h(max)=10*10*0.5*0.5/2*10= 1.25(м)
ответ: h(max)= 1.25(м)