1. определите строение неизвестного алкена а. если известно, что с осадком, полученном при взаимодействии 10,5г а с водным раствором перманганата калия при охлаждении, может прореагировать 250 мл соляной кислоты с концентрацией 1.6 моль/л, а при взаимодействии а с подкисленным раствором перманганата калия при нагревании образуется две карбоновых кислоты. напишите уравнения протекающих реакций. 2. при пропускании паров воды через оксид кальция масса реакционной смеси увеличилась на 9,65%. определите процентный состав полученной твердой смеси. 3. смесь двух солей а и б окрашинает пламя в желтый цвет. эту смесь массой 20 г обработали раствором гидроксида бария при нагревании до прекращения выделения газа. при этом выделилось 2,24 дм? (н. у.) газа в и выпал осадок. газ в отлично растворяется в воде, его раствор имеет щелочную среду, а плотность газа равна 0,759 г дм? . по осадок подействовали избытком соляной кислоты, при этом осадок частично растворился и выделился газ г объемом 1,12 дм- (н. у.) и массой, которая в 6,25 раза меньше массы исходной смеси солсӣ. водный раствор газа г показал слабокислую реакцию среды. после реакции с кислотой осталось 23,3 г твердого остатка. 1) на основании рассуждений и расчётов определите соли а и б, газы в и 2) найдите массы солей в исходной смеси. 3) напишите уравнения всех описанных реакций. 4. в 1897 году американский -органик м. гомберт синтезировал, хотя и с небольшим выходом, углеводород, структура которого по тем временам казалась довольно экзотической. этот углеводород, достаточно высокой устойчивостью, образует бесцветные, нерастворимые в воде кристаллы. он не реагирует ни с бромом, растворённым в четырёххлористом углероде, ни с водным раствором перманганата калия. при каталитическом гидрировании i моль этого углеводорода поглощается 12 моль водорода. массовая доля углерода в этом соединении составляет 93,75 %, а молярная масса находится в интервале 300-350 г моль. молекула углеводорода имеет симметричное строение. 1. определите молекулярную формулу искомого углеводорода. 2. на основании характеристики свойств углеводорода предложите его структурную формулу
1. Докажите опытным путём состав: а) гидроксида кальция; б) сульфата аммония.
а) Проведём качественную реакцию на гидроксид-ион. Для этого воспользуемся индикаторами. Гидроксид кальция - основание малорастворимое, но тем не менее некоторое количество растворяется, следовательно среду изменять будет. Возьмём индикатор фенолфталеин, добавим его в пробирку с гидроксидом кальция, в результате раствор частично изменит цвет на малиновый - следовательно среда щелочная (слабощелочная).
б) Проведём качественную реакцию на сульфат-ион. Для этого возьмём любую растворимую соль бария (по стандарту - хлорид бария), добавим его в раствор с сульфатом аммония. В ходе реакции выпадает белый осадок - сульфат бария. Реакция выглядит следующим образом:
ᅠᅠ
2. Испытайте растворы нитрата натрия, карбоната натрия и нитрата цинка раствором индикатора или индикаторной бумагой, и объясните результаты испытаний. Запишите молекулярные и ионные уравнения реакций гидролиза:
1. Нитрат натрия - соль, образованная сильным основанием NaOH и сильной кислотой HNO₃, гидролиз протекать не будет, среда нейтральная. Это можно доказать следующим путём: возьмём индикатор метиловый оранжевый, добавим его в раствор нитрата натрия, в результате цвет изменится на оранжевый. Это и есть признак нейтральной среды.
2. Карбонат натрия - соль, образованная сильным основанием NaOH и слабой кислотой H₂CO₃. Гидролиз протекает по аниону, образующаяся среда - щелочная, гидролиз обратимый, протекает в две стадии:
ᅠᅠ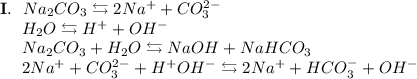
ᅠᅠ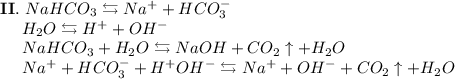
Добавим в раствор метиловый оранжевый. Раствор поменяет цвет на жёлтый, следовательно реакция среды щелочная.
3. Нитрат цинка - соль, образованная слабым основанием Zn(OH)₂ и сильной кислотой HNO₃. Гидролиз протекает по катиону, образующаяся среда - кислая, гидролиз обратимый, протекает в две стадии:
ᅠᅠ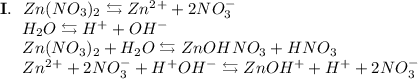
ᅠᅠ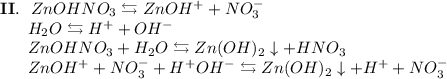
Добавим в раствор метиловый оранжевый. Раствор поменяет цвет на красный, следовательно реакция среды кислая.
3. Практически осуществите все следующие превращения: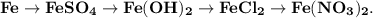
1. Получим сульфат железа путём реакции железа и разбавленной серной кислоты:
ᅠᅠ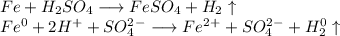
С точки зрения ОВР:
ᅠᅠ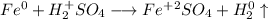
ᅠᅠ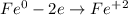 | 2 | 1 | окисление
| 2 | 1 | окисление
ᅠᅠ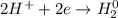 | 2 | 1 | восстановление
| 2 | 1 | восстановление
ᅠᅠFe - восстановитель, H₂SO₄ (2H⁺) - окислитель.
2. Получим гидроксид железа путём реакции сульфата железа и гидроксида калия:
ᅠᅠ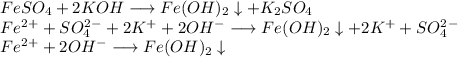
3. Получим хлорид железа путём реакции гидроксида железа и хлороводородной кислоты:
ᅠᅠ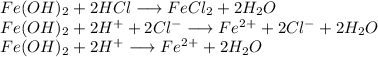
4. Получим нитрат железа путём реакции хлорида железа и азотной кислоты: