1.
А. 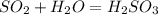
Б. 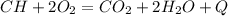
В. 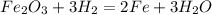
1.
А. 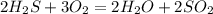
Б. 
В. 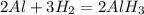
2.
mH2O = 35г
mсоли = 10г
mраствора = mсоли+mводы = 35г+10г = 45г
w = mсоли/mр-ра = 10г/45г*100% = 22,2%
2.
mр-ра = 300г
wсоли = 0,05
mсоли = w*mр-ра = 0,05*300г = 15г
mводы = mр-ра - mсоли = 300-15 = 285г
3.
C -> XH4 -> CO2 -> H2CO3
1. C + 2H2 = CH4 - соединение, обр. метан
2. CH4 + 2O2 = CO2 + 2H2O - разложение, с образованием углекислого газа и воды.
3. CO2 + H2O = H2CO3 - соединение, обр. уголная кислота
3.
Al -> Al2O3 -> Al -> Al(OH)3
1. 4Al + 3O2 = 2Al2O3 - соединение, обр. оксид алюминия.
2. 2Al2O3 --эл. ток--> 4Al + 3O2 - разложение, обр. алюминий и кислород
3. 2Al + 6H2O = 2Al(OH)3 + 3H2 - замещение, обр. гидроксид алюминия и водород.
1) Добавляем в каждую пробирку гидроксид бария. Реакция пойдет лишь в пробирках, содержащих сульфат-ион (мы это определим увидев осадок на дне пробирки). Соответственно сразу мы определяем нитрат аммония, с которым не было реакции.
2) Ba(OH)2 + H2SO4 + BaSO4(осадок) + H2O
Ba(OH)2 + (NH4)2SO4 = BaSO4(осадок) + 2NH3 + 2H2O
В общем-то, в последней реакции мы почувствуем запах выделяющегося аммиака и тем самым сразу поймем, где сульфат аммония.
Конечно, можно начать извращаться, и скажем подлить некое кол-во серной кислоты везде, а потом швырнуть туда кусок. какого-нибудь малоактивного металла, чтобы пошла сложная окис.-восстан. реакция в той пробирке, где была серная кислота, но все это лишне.
Итак, мы одним веществом определили все остальные.
Объяснение:
1. H2S - сероводород (у H+1, у S-2)
2. H2SO3 - сернистая кислота (у H+1, у S+4, у O-2)
3. HNO3 - азотная кислота (у H+1, у N+5, у O-2)
4. HNO2 - азотистая кислота (у Н+1, у N+3, у О-2)
5. H3PO4 - фосфорная кислота (у Н+1, у Р+5, у О-2)