H₂SO₄ + 2KCl = 2HCl + K₂SO₄
Раз серная кислота нам дана в избытке, то хлорид калия прореагирует полностью.
M(KCl)= 74,5 г/моль
M(HCl)= 36,5 г/моль
m(KCl)= 14,9 г
m(HCl)= х г
1) Найдем массу выделившегося хлороводорода из уравнения реакции (теоретический выход):
2×74,5 г KCl дают 2×36,5 г HCl
14,9 г KCl дают х г HCl
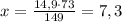 г HCl
г HCl
2) Найдем массу реального HCl:
7,3 г - это 100% выхода
у г - это 70% выхода
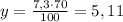 г HCl
г HCl
2) Масса раствора хлороводорода:
mраствора=m(HCl) + m(H₂O) = 5,11+200=205,11 г
3) Найдем массовую долю:
ω=m(вещества)÷m(раствора)×100%=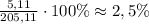
ответ: массовая доля хлороводорода 2,5%.
1) 2Al+6HCl=2AlCl3+3H2
m(HCl)=200*0,1=20г
M(HCl)=36,5г/моль m(HCl)=36,5*6= 219г
M(AlCl3)=133,5 г/моль
m(AlCl3)=2*133,5=267г
Составляем пропорцию :
20г(HCl) - x г(AlCl3) х=20*267/219=примерно 24,38г - масса образовавшейся
219г(HCl) - 267г(AlCl3) соли AlCl3
2)CaCO3= CaO+CO2
m(примеси)= 200*0,1=20 г
m(чист. известняка)=200-20=180 г
M(CaCO3)=100 г/моль m(CaCO3)=100г
пропорция: 180 г извести - х л CO2
100 г извести - 22,4 л CO2( молярный объем на 1 моль в-ва)
х=40,32 л CO2
3)H2SO4+ 2NaOH=Na2SO4 +2H2O
M(NaOH)=40г/моль m(NaOH)=M*n=40*2=80г
пропорция: хг Н2SO4 - 100 г NaOH
98 г H2SO4 - 80 г х=122,5 г серной кислоты
4) FeSO4 +2KOH= Fe(OH)2(в осадке) +K2SO4
m(FeSO4)= 300*0,2=60 г
M(FeSO4)=152 г/моль m(FeSO4)=152 г
M(Fe(OH)2)=90г/моль m(Fe(OH)2)=90г
пропорция: 60 г FeSO4 - x г осадка Fe(OH)2
152 г FeSO4 - 90 г Fe(OH)2 x=примерно 35,53 г осадка
по-моему,как-то так