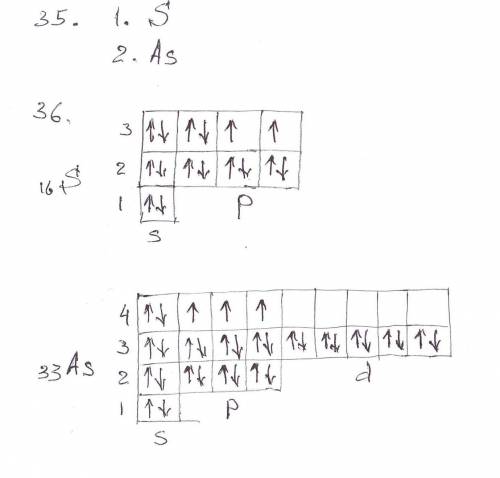
36. Дописать название подуровня и его номер. Записать химический знак элемента и перед ним поставить его порядковый номер. (См. в файл)
37. Номеру данного периода.
38. Номеру группы.
39. Количеством валентных электронов, т.е. электронов на внешнем слое.
40. Изменением строения их электронных оболочек. В каждом периоде происходит заполнение электронами внешнего энергетического уровня до восьми. Следовательно, электронные конфигурации наружных энергетических уровней периодически повторяются.
41. s-элементы - это элементы главной подгруппы I и II групп. По факту это элементы у которых заполняется s-уровень. В каждом периоде по 2 s-элемента.
42. р-элементы - это элементы III-VIII групп, главных подгрупп. Это элементы у которых заполняется р-уровень. Всего 6 р-элементов в каждом периоде (кроме первого, их там нет; и седьмого - хотя там тоже их 6 штук).
43. d-элементы - это элементы I-VIII групп, побочных подгрупп. Это элементы у которых заполняется d-уровень. В каждом большом периоде по 10 d-элементов.
Объяснение:
M(BaSO₄)= 137+32+16x4=233г./моль
m=nxM m(BaSO₄)=n(BaSO₄) x M(BaSO₄)=0,04мольх233г./моль= 9,32г.
6. ответ: при взаимодействии 26,1г.нитрата бария с 4,5г. серной кислоты образуется осадок сульфата бария массой 9,32г.
V=22.4л
Объяснение:
1моль=22.4л
1атом=22.4л
Э(H2)=22.4л