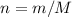 .
. 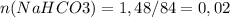 моль.
моль.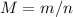 . M (CnH2nO2)=2.44/0.02=122 г/моль.
. M (CnH2nO2)=2.44/0.02=122 г/моль.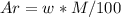 . Ar (C)=68.85*122/100=84. Найдем, сколько атомов углерода входит в соединение, разделив на атомную массу одного углерода: 84/12=7. Тогда, формула кислоты будет иметь вид: C7H14O2. Рассчитаем молекулярную массу полученной кислоты: 12*7(C)+14*1(H)+16*2(O)=130 г/моль. Получается, что 8 атомов водорода лишние (130-122=8).
. Ar (C)=68.85*122/100=84. Найдем, сколько атомов углерода входит в соединение, разделив на атомную массу одного углерода: 84/12=7. Тогда, формула кислоты будет иметь вид: C7H14O2. Рассчитаем молекулярную массу полученной кислоты: 12*7(C)+14*1(H)+16*2(O)=130 г/моль. Получается, что 8 атомов водорода лишние (130-122=8).
Объяснение:
При сгорании 0,89 г органического вещества природного происхождения выделилось 0,672 л (н.у.) углекислого газа,0,63 г воды и 0,112 л (н.у.) азота. Определите молекулярную формулу вещества и предложите структурную формулу этого соединения, если известно, что оно вступает в реакции как с соляной кислотой, так и с этанолом. Напишите уравнение реакции данного вещества с этанолом.
Продукты горения органического вещества: 0,672 л СО2; 0,63 г воды и 0,112 л. N2 или 0,005
Поскольку искомое вещество природное и реагирует с соляной кислотой и этанолом, то предположим, что это не амин, а аминокислота.
Если это кислота то вероятно оно содержит одну аминогруппу- таких аминокислот большинство
Но тогда нужно предположить, что сгорало 0,01 моль вещества
и молекулярная масса предполагаемой аминокислоты равна 89
Среди природных аминокислот выбор невелик
- это α-аланин или β-аланин
СН3- СН - СООН СН2 - СН2 - СООН
I I
NH2 NH2
H2N - CH2 - CH2-COOH + C2H5OH >
- H2O
H2N - CH2 - CH2-COO-C2H5
этиловый эфир 3-аминопропановой кислоты