8.Гидролизом 350г древесных опилок, содержание целлюлозы в которых составляет 45%, было получено 80г глюкозы. Определить массовую долю выхода глюкозы от теоретического.
ответ: ответ ниже. "⇒" и "=" заменить на стандартную "стрелочку" в химии.
Объяснение:
159) a)N( Степень окисления была -3, так как азот связан с тремя водородами, степень окисления которых равна +1) ⇒ N (степень окисления +2, так как связан с кислородом, степень окисления которого равна -2) ; Было -3, а стало +2, значит, N отдал 5 электрона.
б) O ( в 0 степени окисления, так как не связан больше ни с каким элементом) ⇒ O ( - 2 степень окисления, так как связан с двумя водородами, чья степень окисления равна +2) ; Было 0, а стало -2, значит, O получил 2 электрона.
(1-(окисление азота) и (восстановление кислорода)
Там 5 электронов, а здесь 2 электрона. Приводим к наименьшему общему кратному, домножая первую часть уравнения на 2, а вторую - на 5. Получаем (К окислителю 2, к восстановителю 5) . В молекулярной форме это будет : 4NH3+5O2 ⇒ 4NO2 + 6H2O.
В 161 всё аналогично. Сразу перейду к коэффициентам
,( к окислению идёт коэффициент 2, а к восстановителю 3), что в молекулярной формуле 4NH3+3O2⇒ 2N2 + 6 H2O
1. Название – формула Сульфид алюминия – Al₂S₃ Хлорид меди II – CuCl₂ Оксид серы VI – SO₃ Гидроксид бария – Ba(OH)₂ Сульфат железа III – Fe₂(SO₄)₃ Фосфат натрия – Na₃PO₄ Нитрат кальция – Ca(NO₃)₂
2.Формула – название – класс Ba(OH)₂ – гидроксид бария – основания FeO – оксид железа II – оксиды CuSO₄ – сульфат меди II – соли HNO₃ – азотная кислота – кислоты AlCl₃ – хлорид алюминия – соли H₂S – сероводородная кислота (или сероводород) – кислоты CO₂ – оксид углерода IV (или углекислый газ) – оксиды NaOH – гидроксид натрия – основания
3. Формула – название – тип кристаллической решетки Н₂О – вода – молекулярная NaCl – хлорид натрия – ионная Fe – железо – атомная NaOH – гидроксид натрия – ионная O₂ – кислород – молекулярная алмаз – C (углерод) – атомная Cu – медь – атомная Al₂O₃ – оксид алюминия – молекулярная Ионная кристаллическая решетка – типичный металл + типичный неметалл Молекулярная – вещества с ковалентной связью (как полярной, так и неполярной)
4. Не увидел, что нитрит алюминия существует, но Al(NO2)2 (Al, N, O алюминий, азот, кислород) --> Al(OH)3 (гидроксид алюминия) --> Al2O3 (оксид алюминия)
5. Формула количества вещества – n = m/M, где m - масса вещества, M - молярная масса n(H₃PO₄) = m(H₃PO₄) / M(H₃PO₄) M(H₃PO₄) = 1*3 + 31 + 16*4 = 98 г/моль n(H₃PO₄) = 392 г / 98 г/моль = 4 моль N(количество атомов) = n*Na(число Авогадро, 6*10²³) N(H) = 3*6*10²³ = 18 * 10²³
ответ: ответ ниже. "⇒" и "=" заменить на стандартную "стрелочку" в химии.
Объяснение:
159) a)N( Степень окисления была -3, так как азот связан с тремя водородами, степень окисления которых равна +1) ⇒ N (степень окисления +2, так как связан с кислородом, степень окисления которого равна -2) ; Было -3, а стало +2, значит, N отдал 5 электрона.
б) O ( в 0 степени окисления, так как не связан больше ни с каким элементом) ⇒ O ( - 2 степень окисления, так как связан с двумя водородами, чья степень окисления равна +2) ; Было 0, а стало -2, значит, O получил 2 электрона.
Там 5 электронов, а здесь 2 электрона. Приводим к наименьшему общему кратному, домножая первую часть уравнения на 2, а вторую - на 5. Получаем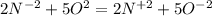 (К окислителю 2, к восстановителю 5) . В молекулярной форме это будет : 4NH3+5O2 ⇒ 4NO2 + 6H2O.
(К окислителю 2, к восстановителю 5) . В молекулярной форме это будет : 4NH3+5O2 ⇒ 4NO2 + 6H2O.
В 161 всё аналогично. Сразу перейду к коэффициентам