ответ:NH3+HNO3=NH4NO3
Мне непонятно, что такое 98. Предполагаю, что это содержание основного вещества в селитре.
1. Определим сколько кмоль селитры мы получим в результате реакции.
1000 кг*0,98/(14+4+14+48)=12,25 кмоль
2. По уравнению реакции, 1 кмоль селитры получается из 1 кмоль аммиака, следовательно необходимо 12,25 кмоль аммиака, что соответствует 12,25*(14+3)=208,25 кг= 0,20825 тн аммиака - ответ
3. По уравнению реакции, 1 кмоль селитры получается из 1 кмоль азотной кислоты, следовательно необходимо 12,25 кмоль 100% азотной кислоты, что соответствует 12,25*(1+14+48)=771,75 кг 100% азотной кислоты
4. Пересчитаем на 55% азотнуюкислоту 771,75/0,55= 1403,18 кг= 1,403 тн 55% азотной кислоты - ответ
Объяснение:
Объяснение: Сила кислот отпределяется отдавать водород(диссоциировать в растворе на катион H⁺ и анион кислотного остатка), так вот.
Есть такая штука как электронная плотность(сами электроны) или как ее еще называют: "электронное одеяло". Более электроотрицательный элемент тянет на себя электронное одеяло от менее электроотрицательного элемента(это в парах Неметалл+Неметалл, т.к. в паре Металл+Неметалл все и так понятно). Что это значит? Например в молекуле HF есть H⁺ + F⁻, т.е. фтор забрал 1 электрон у водорода благодаря своей электроотрицательности. Почему? Потому что он может.
Итак, вернемся к кислоте. В пропионовой кислоте нам важно рассмотреть водород в составе OH(в COOH). По дефолту, с него тянет ЭП(электронная плотность) кислород(O-H). Когда в кислоте появляется Cl например, то ЭП с этого кислорода НЕМНОГО/ЧУТЬ/ЛЕГОНЬКО(никто не говорил что хлор сможет полностью сместить электронное одеяло на себя) отходит в сторону Cl, следовательно у водорода(в OH) ЭП забрали и он думает свалить, мол ловить здесь уже нечего, единственный электрон был, и его забрали. И получается так, что кислота легче диссоциирует на H⁺ и анион кислотного остатка. Что уж говорить про фтор. Он не просто НЕМНОГО сместит электрон от кислорода, а просто его заберет. Полностью. Без остатка. Ну или целых 2 фтора, как дано в 4 кислоте.
Что насчет 5 кислоты? Там ведь ни Cl, ни F. Никого нету. Для таких случаев есть правило: "Чем больше углеродов в кислоте - тем она слабее". Следовательно на первом месте муравьиная кислота(hcooh), потому что у нее только 1 углерод в составе карбоксила. в 5 кислоте целых 5 углеродов, поэтому она ни в какое сравнение с кислотами, перечисленными выше не идет.
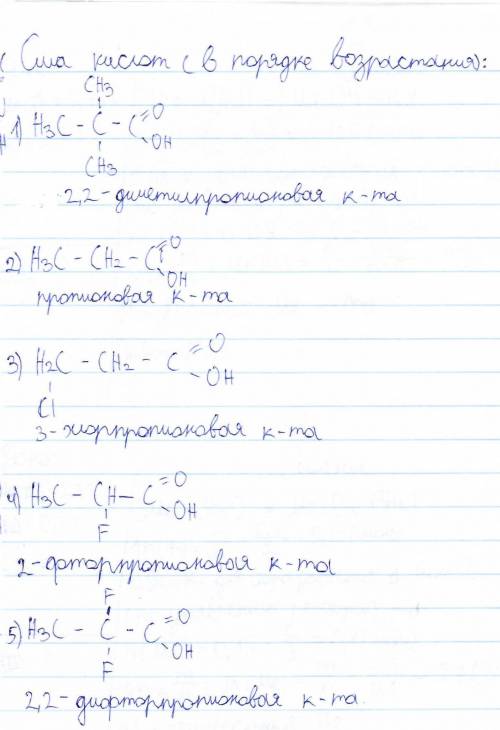
1. 1) Щёлочи:
Щёлочь + кислота = соль + вода
NaOH + HCl → NaCl + H₂O
Na⁺ + OH⁻ + H⁺ + Cl⁻ → Na⁺ + Cl⁻ + H₂O
H⁺ + OH⁻ → H₂O
Щелочь + оксид металла = соль + вода, ЕСЛИ ОКСИД МЕТАЛЛА - АМФОТЕРНЫЙ
2KOH + Al₂O₃ → 2KAlO₂ + H₂O
2K⁺ + 2OH⁻ + Al₂O₃ → 2K⁺ + 2AlO₂⁻ + H₂O
Al₂O₃ + 2OH⁻ → 2AlO₂⁻ + H₂O
Щелочь + соль = основание + соль
2LiOH + Zn(NO₃)₂ → 2LiNO₃ + Zn(OH)↓ (реакция возможна, если образуется осадок)
2Li⁺ + 2OH⁻ + Zn²⁺ + 2NO₃⁻ → 2Li⁺ + 2NO₃⁻ + Zn(OH)₂↓
Zn²⁺ + 2OH⁻ → Zn(OH)₂↓
2) Нерастворимое основание:
Нерастворимое основание + кислота = соль + вода
Cu(OH)₂ + H₂SO₄ → CuSO₄ + 2H₂O
Cu(OH)₂ + 2H⁺ + SO₄²⁻ → Cu²⁺ + SO₄²⁻ + 2H₂O
Cu(OH)₂ + 2H⁺ → Cu²⁺ + 2H₂O
Нерастворимое основание → t° → оксид металла + вода
Mn(OH)₂ → MnO + H₂O
2. Как характеризовать гидроксид бария по таблице 11 - не ясно. Напишу все, что знаю по нему:
Гидроксид бария - Ba(OH)₂: растворимое основание, проявляет оснОвные свойства. Взаимодействует с кислотами с образованием соли и воды:
Ba(OH)₂ + 2HNO₃ → Ba(NO₃)₂ + 2H₂O
Взаимодействует с кислотными оксидами с образованием солей и воды:
Ba(OH)₂ + SO₃ → BaSO₄↓ + H₂O
Взаимодействует с амфотерными оксидами и гидроксидами:
Ba(OH)₂ + 2Al(OH)₃ → Ba[Al(OH)₄]₂
Ba(OH)₂ + Al₂O₃ → Ba(AlO₂)₂ + H₂O
И взаимодействует с солями (если образуется осадок)
Ba(OH)₂ + Na₂SO₄ → BaSO₄↓ + NaOH
Решение 3 во вложении ↓
НО никакого осадка там не образуется... Na₂CO₃ - растворим в воде, можно убедится по таблице растворимости