Оксиды весьма разнообразны по своим физическим свойствам. Они могут быть как жидкостями (Н2О), так и газами (СО2, SO3) или твёрдыми веществами (Al2O3, Fe2O3). Приэтом оснОвные оксиды, как правило, твёрдые вещества. Окраску оксиды также имеют самую разнообразную — от бесцветной (Н2О, СО) и белой (ZnO, TiO2) до зелёной (Cr2O3) и даже чёрной (CuO).
Основные оксиды
Некоторые оксиды реагируют с водой с образованием соответствующих гидроксидов (оснований):Основные оксиды реагируют с кислотными оксидами с образованием солей:Аналогично реагируют и с кислотами, но с выделением воды:Оксиды металлов, менее активных чем алюминий, могут восстанавливаться до металлов:
Кислотные оксиды
Кислотные оксиды в реакции с водой образуют кислоты:Некоторые оксиды (например оксид кремния SiO2) не взаимодействуют с водой, поэтому кислоты получают другими путями.
Кислотные оксиды взаимодействуют с основными оксидами, образую соли:Таким же образом, с образование солей, кислотные оксиды реагируют с основаниями:Если данному оксиду соответствует многоосновная кислота, то так же может образоваться кислая соль:Нелетучие кислотные оксиды могут замещать в солях летучие оксиды:
Амфотерные оксиды
Как уже говорилось ранее, амфотерные оксиды, в зависимости от условий, могут проявлять как кислотные, так и основные свойства. Так они выступают в качестве основных оксидов в реакциях с кислотами или кислотными оксидами, с образованием солей: И в реакциях с основаниями или основными оксидами проявляют кислотные свойства:
Объяснение:
1) Находим массу вещества:
Мг(СхНуОz) = 15 * 2 = 30 г.
2) Находим количество вещества CO2:
n = 11/44 = 0.25 моль
3) Находим количество вещества С:
n = 0.25 * 1 = 0.25
4) Находим массу С:
m (C) = 0.25 * 12 = 3 г.
5) Находим количетво вещества Н2О:
n = 4.5/18 = 0.25 моль
6) Находим количество вещества Н2:
n(H2) = 0.25 * 2 = 0.5 моль
7) Находим массу Н:
m(H) = 0.5 * 1 = 0.5 г.
8) Находим общую массу углерода и водорода:
0.5 + 3 = 3.5г.
9) Найдем массу кислорода.
m (O) = 7.5 - 3.5 = 4 г.
10) Надем количество вещества кислорода:
n (O) = 4/16 = 0.25 моль.
11) Атомарные факторы:
С:Н:О = 0.25:0.5:0.25 = 1:2:1
Формула СН2О
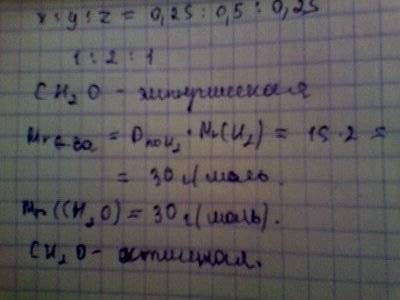

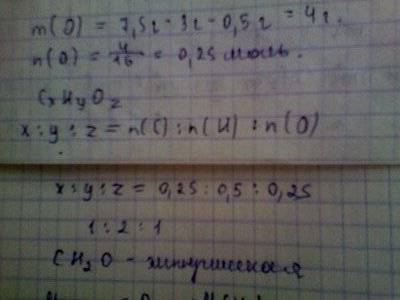
1. Б
2. А
3. В
4. Г
Объяснение: