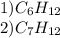
Решение в прикрепленном файле PDF
Объяснение к 1 задаче:
Находим количество вещества продуктов, от этого находим количество вещества атомов водорода и углерода, находим массы атомов углерода и водорода, выполняем проверку на наличие еще одного элемента в X. Массы сошлись, значит в X только углерод и водород. Находим отношение количества молекул в в-ве. Записываем формулу и отсюда молярную массу в-ва через n. Приравняем массу найденную через плотность по воздуху и через формулу. Находим число атомов углерода и водорода
Объяснение к 2 задаче:
Находим долю водорода. Находим отношение атомов C и N через относительные количества вещества, записываем общую формулу в-ва, выражаем молярную массу. Находим молярку через плотность по воздуху и приравниваем с формулой. Находим число атомов углерода и водорода
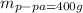
Объяснение:
Пусть было x грамм 80% кислоты (тогда масса кислоты 0.8x)
В раствор добавили y грамм 15% кислоты (тогда масса кислоты в другом растворе, который добавили 0.15y)
Тогда получился раствора массой x + y (650 грамм по условию) и масса кислоты в нем 0.8x + 0.15y, а ее доля равна 0.4. Составим уравнение:
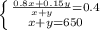
1 уравнение: массовая доля кислоты равна массе кислоты делить на массу раствора и равно 40%
2 уравнение: по условию конечная масса раствора 650 грамм
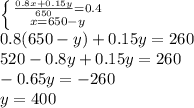
Как мы помним y - масса добавляемого раствора
1а ответ = 44,8 , потому что 1 моль любого газа занимает объем 22,4 литра
1б 12*10 в 23 степени
1в 1 грамм
2а V(O2)=n * Vm = 0.5*22.4 =11.2
2б В 11,2 литрах СО2 содержится 0,5 моля, в каждой молекуле - два атома кислорода. Значит количество атомов кислорода равно
2*0,5* 6*10^23 = 6*10^23 атомов
2в Масса 0,5 моль О2 равна 16 грамм
3а Zn+2HCl=ZnCl2+H2
13г m
65г 2г
m(H2)=13г*2г/65г=0,4
n(H2)=0.8МОЛЬ
Vm=V|n
V=Vm*n
V(H2)=22.4л\моль* 0,8моль=17,92л
ответ: V(H2)=17.92Л