4) 3 и 4
5) В первой пробирке кислота, во второй соль.
6) Из электролитов это могут быть: 1) щелочи (гидроксиды натрия, бария и др.); 2) соли, гидролизующиеся по катиону (карбонат натрия, гидрокарбонат калия и др.); 3) мыла (соли органических кислот), например, стеарат натрия. В растворах этих веществ присутствуют гидроксид-ионы, придающие раствору мылкость.
7) хлорид цинка, кислота, иодид калия
Объяснение:
5) Катион водорода и анион кислотного остатка представляют собой кислоту – H3PO4. Катион метала и анион кислотного остатка представляют собой соль Na3PO4.
7) Без ступеней диссоциируют все соли, сильные кислоты и щелочи.
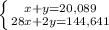
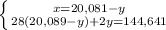
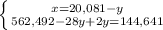
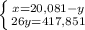
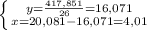
2NH3 + O2 = 2NO + 3H2
V(O2) = кол-во вещества(O2) * V молярный
из уравнения находим кол-во вещества(O2), это равно 0,06 моль
V(O2) = 0,06 моль * 22,4л/моль = 1,344 л