Если: а) в атоме элемента имеется 3 электронных слоя и на внешнем слое имеется пять электронов, то этот элемент расположен в 3 периоде в VА группе. Это неметалл фосфор.
б) у атома элемента имеется 13 протонов, значит его порядковый номер = 13. Это металл алюминий.
Фосфор и алюминий могут реагировать между собой с образованием фосфида алюминия:
Al + P → AlP (реакция идет при температуре 500°C)
Химическая связь в соединении фосфид алюминия ионная. Алюминий имеет 3 валентных электрона, которые отдает в процессе образования химической связи и превращается в положительный ион - катион Al⁺³.
Фосфор имеет 5 валентных электронов, ему не хватает трех электронов до завершения внешнего электронного уровня. Фосфор принимает 3 электрона и превращается в ион - анион P⁻³.
Между положительным и отрицательным ионами за счет электростатического притяжения образуется ионная связь.
Схема в приложении.
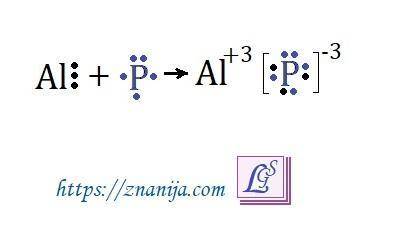
Дано: y(CuO)=0,6 моль. Знайти m(CuSO4)-?
Розв'язання.
Записуємо рівняння реакції:
0,6 моль х г
CuO + H2SO4 = CuSO4 +H2O
1 моль 160 г
Над формулами речовин записуємо дані, що є за умовою задачі.
Мольні співвідношення речовин показують коефіцієнти рівняння. Прореагувало 1 моль купрум (ІІ) оксиду CuO з утворенням 1 моль солі купрум сульфату CuSO4.
Обчислюємо молярну масу (M г/моль = Mr) солі й, відповідно, масу 1 моль.
Mr(CuSO4)=Ar(Cu)+Ar(S)+4•Ar(O)=64+32+4•16=160, M(CuSO4)=160 г/моль. Маса 1 моль=160 г.
Записуємо під формулами речовин у рівнянні реакції.
Складаємо пропорцію і розв'язуємо її.
0,6 моль / 1 моль= х г / 160 г, звідси х=0,6 моль•160 г/1 моль=96 г.
Відповідь: m(CuSO4)=96 г; купрум сульфат.
Объяснение:
2HCL+2K-->2KCL+H2
3H2SO4+2Al-->Al2(SO4)3+3H2
HCL+Cu≠
2H3PO4+3Mg-->Mg3(PO4)2+3H2
2H3PO4+3Ag-->Ag3PO4+3H2
2H3PO4+2Au-->2AuPO4 + 3H2
Объяснение: