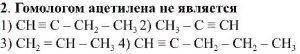
Объяснение:
2.6.1. Если мы растворяем 5 граммов соли в 60 граммах воды, то общая масса раствора будет равна 5 + 60 = 65 граммов, и он будет содержать 5 граммов соли. Значит, массовая доля соли в растворе равна 5:65 = 0,0769, или 7,69%.
2.6.2. У нас есть раствор соляной кислоты HCl с молярной концентрацией эквивалента (по-другому - нормальностью) 10,22 моль-экв/л. Молярная масса эквивалента HCl равна 1 + 35,5 = 36,5 г. Это означает, что в 1 литре такого раствора содержится 10,22*36,5 = 373,03 грамма чистой кислоты. Масса 1 литра такого раствора равна 1,160*1000 = 1160 граммов. Тогда массовая доля кислоты в таком растворе равна 373,03:1160 = 0,3216, или 32,16%. Молярная концентрация совпадает с нормальной, так как фактор эквивалентности для НСl равен 1. Титр раствора показывает, какая масса кислоты содержится в одном миллилитре раствора: 373,03:1000 = 0,3730 г/мл. (с точностью до десятитысячных).
2.6.3. Если 1 литр раствора содержит 20 граммов NaOH, что составляет 20:40 = 0,5 моль, то молярная концентрация такого раствора равна 0,5 моль/л и совпадает с его нормальностью: 0,5 моль-экв/л (обычно принято выражать в грамм-эквивалентах, тогда 40 г-экв./л).
Pb(NO3)2 + Zn → Pb + Zn(NO3)2 Синтез
Нитрат Свинца(II) + Цинк = Свинец + Нитрат Цинка
Zn + I2 → ZnI2 Синтез
Цинк + Молекулярный Иод = Иодид Цинка
Zn⁰ (s) + I⁰2 (s) → Zn²I⁻¹2 (s)
Zn⁰ - 2 e⁻ → Zn² (окисл)
2 I⁰ + 2 e⁻ → 2 I⁻¹ (восст)
Zn - восстановитель
I2 - окислитель
ZnI2 - ионная связь
2Zn + O2 → 2ZnO Синтез
Цинк + Молекулярный Кислород = Оксид Цинка
ZnO + CO2 → ZnCO3 Синтез
Оксид Цинка + Оксид Углерода(IV) = Kарбонат цинка
ZnO + H2SO4 → H2O + ZnSO4 Реакция обмена
Оксид Цинка + Серная Кислота = Вода + Cульфат цинка
ZnSO4 + 2NaOH → Zn(OH)2 + Na2SO4 Реакция обмена
Cульфат цинка + Гидроксид Натрия = Гидроксид цинка + Сульфат Натрия
Объяснение:
3, потому что ацетилен имеет тройную связь, а вещество под номером 3 имеет двойную связь
Объяснение: